Es un síndrome que resulta de una falla hemodinámica grave, con perfusión inadecuada de los tejidos y anoxia celular.
Se lo puede describir también, como un proceso agudo, desencadenado por la alteración de uno o más mecanismos preso-reguladores:
Volumen minuto
Volemia
Resistencia periférica
Cuya base fisiopatológica reside en la hipoxia hística, resultante de alteraciones que con influencia recíproca se producen entre la microcirculación, las membranas y el metabolismo celular.
Clinicamente se traduce por síntomas y signos dependientes de:
1) La hiperactividad adrenérgica
2) Del trastorno hemodinámico predominante
3) Del daño celular: Hipoxia, acidosis metabólica, alteraciones funcionales
El shock de acuerdo a su etiología se puede denominar:
Traumático:
- Shock del quemado
- Hipovolémico, hemorrágico
Neurógeno
Infeccioso
Cardiogénico
El shock se presenta cuando el flujo sanguineo en los tejidos es insuficiente para mantener la actividad normal de sus células
El síndrome de shock se asocia siempre con una tensión arterial disminuida, aunque no son sinónimos. Una T.A. baja no siempre indica un flujo sanguineo inadecuado.
Signos clínicos
Palidez
Frialdad
Piel húmeda
Ansiedad
Taquicardia
Taquipnea
Oliguria
Test de relleno capilar retardado
Tensión arterial normal o disminuida
El sistema simpático adrenal está activado, dirigido a compensar el descenso de la presión arterial; esta respuesta podría ser peligrosa en algunos casos.
FISIOPATOLOGIA
La vasoconstricción en arteriolas y vénulas causa una anoxia isquémica, la que en tiempo variable va seguida de pérdida del tono de las arteriolas y obstrucción del flujo en las vénulas.
La anoxia por estancamiento se produce por constricción venular persistente, agregación celular en la circulación retardada y probablemente microtrombosis en la fase terminal.
La respuesta vasoconstrictora en la microcirculación se encuentra inicialmente restringida a piel, hígado, pulmones, intestino y riñón; órganos sensibles a catecolaminas como adrenalina y noradrenalina.
Cuando el volumen hemático se encuentra deplecionado, se produce la activación de los barorreceptores en cava, aorta y probablemente en todo el sistema vascular. Estos barorreceptores activan un receptor simpático en cerebro, que estimula la secreción de adrenalina y noradrenalina en las terminaciones post-sinápticas y que producen además liberación de adrenalina a nivel de la médula suprarrenal; esto genera constricción más importante en piel, riñón, hígado y pulmones, por tener receptores alfa, mientras que corazón y músculo tienen beta y se vasodilatan, en corazón se produce inotropismo positivo, lo que mejora la perfusión cerebral que no tiene receptores alfa ni beta.
La persistencia del hipertono lleva a la anoxia y a la acidosis, lo que produce a su vez, encharcamiento y trombosis, continuándose la producción de ácidos por la anoxia.
La anoxia y acidosis relajan el esfinter arterial, pero se mantiene la contracción del esfinter venular, menos sensible al descenso de oxígeno y a la acidosis.
Progresando el proceso fisiopatológico, el consumo de factores por encharcamiento, puede producir hemorragia de las mucosas
Consecuencias de la anoxia por estancamiento
La glucosa entra a la célula con la ayuda de insulina, para formar glucosa 6 fosfato, que por el ciclo anaeróbico citoplasmático, produce del 15 al 20 % de la energía, el resto del ATP se produce en la mitocondria en el ciclo aeróbico de Krebs.
La falta de O2 no permite una producción adecuada de energía, no se mantienen las membranas, se alteran las bombas de sodio y potasio, saliendo potasio al compartimiento extracelular y entrando sodio y agua a la célula, edematizándose; se liberan las enzimas lisosomales, se producen polipéptidos tóxicos, que ocasionan aun más daño.
Otro efecto lesivo de la anoxia por estancamiento, es la reducción del retorno venoso y en consecuencia del volumen circulatorio eficaz.
El volumen circulatorio eficaz también se reduce por la salida de albúmina plasmática al intersticio.
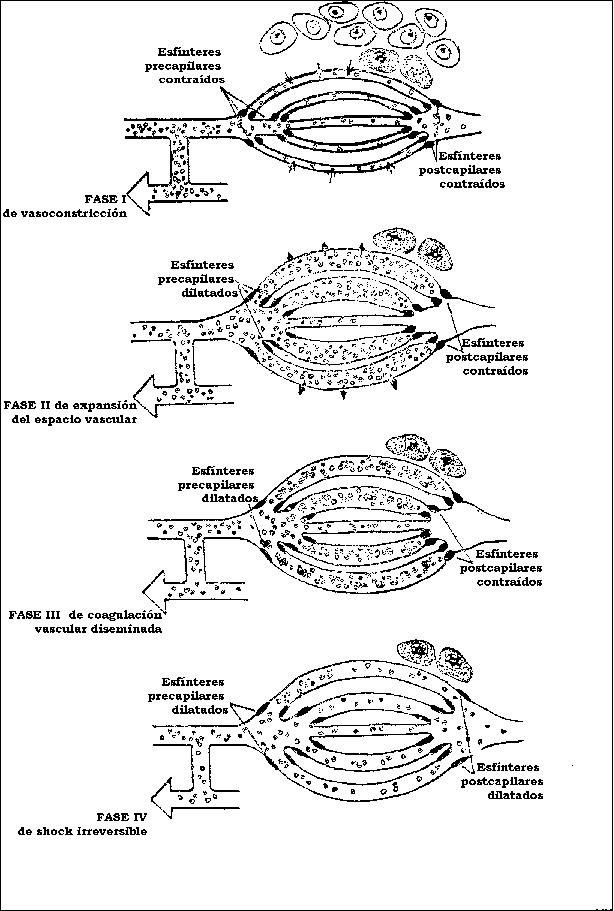
REPRESENTACION ESQUEMATICA DE LA FISIOPATOLOGIA
DEL SISTEMA CAPILAR EN LAS FASES DEL SHOCK
REPRODUCIDO DE «LECCIONES DE CIRUGIA» CON AUTORIZACION
DEL DR RAUL FLORES HUSON
SHOCK SEPTICO
El shock puede depender de infecciones por bacterias Grampositivas que originan pérdidas masivas de líquidos como en la fascitis necrosante, o por diseminación de una exotoxina potente, por clostridium perfingens. Con mayor frecuencia por diseminación de una infección fulminante por estafilococos, estreptococos o neumococos; el shock guardaría relación con la liberación de exotoxinas por parte de diversas cepas de estafilococos y estreptococos, aunque no de neumococos.
El tratamiento consiste en proporcionar antibióticos apropiados, drenaje quirúrgico cuando está indicado y corrección del déficit volumétrico.
Todas las bacterias Gramnegativas: E. coli, klebsiella, aerobacter, pseudomonas, proteus, coliformes, bacteroides, contienen un lipopolisacárido complejo en la pared celular, denominado endotoxina. La endotoxina a la muerte bacteriana, forma complejos con complemento, anticuerpos y otros factores, de acción simpático-mimética.
Esta endotoxina activa se denomina anafilotoxina, que produce más rápidamente el cambio de la microcirculación de isquémica en estancada.
La pérdida de volúmen sanguineo en la circulación estancada, reduce el retorno venoso, el flujo cardíaco y la presión arterial, entrando nuevamente en juego los baro-receptores y el aumento de la actividad simpática.
La endotoxina activada actua directamente sobre el sistema nervioso central, produciendo desorientación y coma, taquipnea y taquicardia.
El gasto cardíaco en el shock séptico puede estar normal o elevado, la resistencia periférica puede estar normal o disminuida.
La resistencia periférica disminuida, como el gasto cardíaco aumentado y el bajo consumo de oxígeno hístico, se explicaría por la existencia de cortocircuitos arteriovenosos, a nivel de pulmones y en los lugares donde se localiza la sepsis, además de la hipoxia isquémica y luego el encharcamiento, se agregan luego los shunts, pues cuando se produce infección, la resistencia al flujo se puede hacer tan importante, que se abren los cortocircuitos arteriovenosos, participarían además factores químicos producidos por la inflamación.
Su mayor incidencia corresponde a personas de 70 a 80 años
El origen más frecuente de las infecciones por bacterias gramnegativas es el sistema urogenital, por operaciones e instrumentación de vías urinarias. El segundo sitio más frecuente es el aparato respiratorio; en muchos pacientes la infección va precedida de traqueostomía.
El tercer lugar lo ocupa el aparato digestivo, con trastornos como peritonitis, absceso intraabdominal e infecciones de vías biliares y el cuarto corresponde a enfermedades del sistema tegumentario, con inclusión de quemaduras e infección de tejidos blandos. Los catéteres I.V. a permanencia con fines de hidratación, hiperalimentación y monitoreo son una fuente cada vez más usual de contaminación.
El aparato reproductor es fuente importante de infección, en particular por el aborto séptico y las infecciones puerperales.
TRASTORNOS ACOMPAÑANTES
Trastornos que limitan las funciones cardíaca, pulmonar, hepática y renal, aumentan la suceptibilidad a las infecciones por gérmenes Gramnegativos, Ej diabetes, cirrosis, leucemias, inmunosupresores.
SHOCK CARDIOGENICO
Hay una disminución del flujo cardíaco por infarto, taponamiento cardíaco, neumotorax hipertensivo, arritmia, compresión mediastínica en lesionados, o embolia pulmonar en el postoperatorio, lo que produce descenso de la presión arterial, compromiso de barorreceptores, que activan centros simpáticos cerebrales y producen una respuesta simpático adrenal.
En el shock hay un descenso del volumen de sangre circulante efectiva y una alteración de la microcirculación, que causa una lesión celular.
En esta variante del shock hay falla de la función de bombeo cardíaco. Hay que tratar con prontitud las arritmias cardíacas. El taponamiento cardíaco se ha de aliviar por pericardiocentesis. Cuando la génesis de la falla de bombeo radique en infarto de miocardio o miocarditis, el tratamiento primario se centra en aliviar la disfunción miocárdica y si esta es de gravedad como para producir shock, se administrarán fármacos con efectos inotrópicos positivos y otros tendientes a mejorar la perfusión.
El signo clásico consiste en Presión Venosa Central o de la arteria pulmonar altas, o que se incrementan rapidamente con la fluidoterapia. Esto se acompaña de depresión del gasto cardíaco, que no responde a la fluidoterapia
Esto puede ser considerado como dato histórico
En el shock séptico y en el cardiogénico se consigue un incremento del volúmen sanguineo circulante efectivo, si se moviliza la sangre acumulada que permanece todavía en el interior del sistema vascular, utilizando bloqueantes adrenérgicos alfa, como la fenoxibenzamina y la fentolamina, o con nitroprusiato que actua directamente sobre las arteriolas y vénulas, o con dosis masivas de gluco- corticoides, que producen vasodilatación.
Fenoxibenzamina inicia su acción a los pocos minutos de administrada, dura su acción por 18 Hs y baja P.V.C., T.A. y Presión intracapilar pulmonar, estos parámetros deben ser controlados y si bajan demasiado aumentar el aporte hídrico.
Fentolamina se da por vía endovenosa y actua mientras se administra por perfusión continua.
El nitroprusiato se administra por perfusión, hay que controlar T.A. y presión intracapilar pulmonar, si la presión baja demasiado, se administra dopamina a dosis vasopresoras.
Los corticoides preservan la integridad de los capilares frente a la anoxia, disminuyen la resistencia arteriolar y venular, produciendo además una disminución de la fijación del complemento por anticuerpos y endotoxinas simpáticoactivas.
Para el tratamiento y la evaluación del shock se utilizan catéteres, estos sirven para la administración de fluidos, para la medición de la PVC y para la administración de fármacos cuando se los coloca en las venas, preferentemente en el sistema de vena cava superior: Subclavia , yugulares internas y externas, basílica, cefálica; ya sea por punción o por flebotomía. Se trata de no usar el sistema de vena cava inferior por su tendencia a la aparición de flebitis y aun el riesgo de embolias.
También se usa el cateter de Swan Ganz para determinar presión arterial intracapilar pulmonar.
En algunos centros se utiliza la cateterización intra-arterial, para la medición de presión arterial media; para lo cual se canaliza la arteria radial.
SHOCK NEUROGÉNICO
Surge después de interferencia grave en el equilibrio de los factores vasodilatadores y vasoconstrictores en arteriolas y vénulas.
Pueden ser sus manifestaciones el síncope clínico, oir o ver cosas desagradables, el dolor, la raquianestesia alta, la transección de la médula espinal por traumatismos,
Parece ser debido a un estado de normovolemia con aumento considerable de la capacidad de arteriolas y vénulas, lo que induce disminución del retorno venoso al hemicardio derecho y caida subsecuente del gasto cardíaco.
En caso de no corregir el shock neurógeno, surgen reducción del flujo sanguineo renal y lesiones cerebrales, así como todas las secuelas del shock hipovolémico.
En cuadros leves la simple medida de interrumpir el estímulo o aliviar el dolor es tratamiento adecuado.
El empleo de fluidoterapia y vasopresores (fenilefrina, efedrina) suele producir aumento gradual de la presión arterial y gasto cardíaco.
DIAGNOSTICO DE SHOCK
Disminución de la tensión arterial sistólica: T.A. menor de 90 mm de Hg; o la reducción de 30 mm de Hg a los valores tensionales previos al cuadro en hipertensos.
La piel de las extremidades inferiores se encuentra fría, pálida, cianótica.
El flujo urinario desciende a menos de 30 ml/h.
El descenso de temperatura y del flujo urinario precede a la caída tensional y diagnosticados estos hechos puede reponerse volumen.
Otro parámetro a tener en cuenta como amenaza de shock es si de la valoración del paciente se obtiene un índice cardíaco de menos de 2 litros / minuto / m2; en el shock séptico el índice puede ser normal, 2,5 a 3 o aun 3 a 10 l / min / m2, es decir elevado.
La tensión arterial está determinada por el flujo y por la resistencia periférica, si se eleva la resistencia periférica, se agrava el shock, pues la resistencia ya está muy aumentada, por la respuesta simpático adrenal, resultando una disminución adicional del flujo sanguineo nutritivo, e intensificación de la hipoxia celular.
La mejor medida terapéutica es la reposición del volumen.
En cardiopatías es conveniente realizar la medición de la presión capilar arterial intrapulmonar, para regular la administración de líquidos.
La elección del líquido depende del líquido que se haya perdido.
Además se utilizan agentes para reducir la precarga (arterial) y la post-carga (resistencia venular)
SHOCK HEMORRAGICO
Para el tratamiento del shock hemorrágico, se realizan transfusiones de sangre, se utiliza succinato sódico de metil prednisolona 30 mg/kg, que reduce la precarga y post-carga.
La reposición del volumen en el paciente inestable debe realizarse lo más rapidamente posible.
Daremos una idea de la magnitud de la hemorragia siguiendo los criterios del Comité de Trauma del American College of Surgeons, que las divide en cuatro clases:
CLASE I: Pérdida de hasta el 15 % de la volemia (750 ml para una persona adulta de 70 kg de peso). Síntomas clínicos mínimos. Solo ligera taquicardia, con el resto de los parámetros normales (tensión arterial, presión de pulso, frecuencia respiratoria, relleno capilar, volumen urinario mayor de 30 ml por minuto). La transferencia endógena transcapilar restaura la volemia en 24 hs.
CLASE II: Pérdida de 15 a 30 % de la volemia (750 a 1500ml). Habitualmente el paciente tiene taquicardia, disminución de la presión de pulso, cambios sutiles en el sensorio, como ansiedad, y enlentecimiento del relleno capilar.
El volumen minuto urinario oscila entre 20 y 30 ml / min.
CLASE III: Pérdida de 30 a 40 % de la volemia (1500 a 2000 ml). Signos claros de hipoperfusión periférica, taquicardia, taquipnea, alteración del sensorio e hipotensión arterial. El volumen minuto urinario es de 15 a 20 ml / min.
CLASE IV: Pérdida de más del 40 % de la volemia (más de 2000 ml). Taquicardia, hipotensión arterial severa, oliguria, marcada depresión del sensorio. La pérdida de más del 50 % de la volemia produce pérdida de la conciencia y, habitualmente, paro cardio-respiratorio por exsanguinación.
A diferencia del shock hemorrágico puro, el shock hipovolémico traumático presenta, como elemento propio, la presencia de edema en los tejidos blandos lesionados.
Esto es muy evidente en las fracturas de huesos largos o de pelvis, donde el líquido de edema puede triplicar el volumen de sangre presente en el foco fracturario (regla de 3 a 1).
Reposición de volumen
La reposición de volumen se efectuará inicialmente con solución salina (Solución fisiológica o Ringer lactato).
La administración de solución fisiológica, que contiene 156 meq de cloro y 156 meq de sodio, conlleva la producción de acidosis hiperclorémica por exceso de cloro en su composición. La solución de Ringer al agregar lactato como anión acompañante, evita estos inconvenientes.
Los coloides (Dextrán, Macrodex, etc.) son más caros que los anteriores, pueden alterar la compatibilidad sanguinea y tienen un máximo de administración.
Se prefiere la administración de cristaloides mientras se efectuan las pruebas de compatibilidad necesarias. Es conveniente calentar estas soluciones a 38º C para evitar la hipotermia como consecuencia de la reposición de líquidos.
Debe comenzarse con 2000 ml de cristaloides, en adultos, o 20 ml / Kg en los niños lo más rapidamente posible y evaluar la necesidad de ulterior reposición.
Una vez comenzada la reposición de cristaloides, debe efectuarse lo más rapidamente posible la reposición de sangre.
Las pruebas de compatibilidad pueden tardar hasta 60 minutos, si no se puede esperar se utiliza sangre grupo 0 negativo.
La sangre de banco que ha permanecido almacenada por más tiempo, tiene una curva de disociación de la hemoglobina, hacia la izquierda, es decir que libera el oxígeno con dificultad, por pérdida de los eritrocitos de su reseva de diglicerofosfato y ATP.
Puede usarse respirador cuando es necesario (según hipoxemia e hipercapnia) y diuréticos con leve acción vasodilatadora renal como la fursemida.
ACCESO AL SISTEMA VENOSO
La primera vía venosa debe ser colocada con la metodología con la que esté más familiarizada el médico que la realiza.
La vía subclavia en la emergencia tiene el riesgo de producir neumotorax.
Conviene utilizar catéteres cortos y gruesos calibre 16 o de diámero mayor (14G; 12G; 10G; 8G y 6G). El flujo de infusión de líquido que se podrá introducir en el volumen circulante dependerá del diámetro del cateter utilizado, de su longitud y de la presurización del sistema.
En la emergencia se debe contar con varias vías para la administración de fluidos, si es posible de ambos lados del diafragma, esto asegura la llegada de parte de lo infundido, si está lesionado uno de los sistemas de las venas cavas.
SHOCK CARDIOGENICO
La presión venosa central y la presión intracapilar arteriolar pulmonar están elevadas, la resistencia periférica total también está elevada y hay un bajo índice cardíaco con tensión arterial baja.
Lo enmarcado entre llaves pertenece a un archivo anterior y puede ser histórico
{Se utilizan glucocorticoides que disminuyen la PVC, disminuyen la presión intra-arterial capilar pulmonar (PAWP), reducen precarga y postcarga al reducir resistencia periférica total.} Elevan la TA, la diuresis e índice cardíaco, aumentan el consumo de oxígeno y el aclaramiento de lactato producido en la circulación estancada.
Otro shock cardiogénico aparece después de intervenciones cardíacas, es el shock con síndrome de bajo volumen de expulsión: Con índice cardíaco bajo y con PVC elevada.
Se pueden usar: fenoxibenzamina, fentolamina, nitroprusiato, clorpromazina y succinato sódico de metil prednisolona 30 mg/kg, E.V., una o dos dosis y se logra un aumento de la T.A., disminución de la P.V.C. y de la P.A.W.P.
Estas dosis no producen trastornos de la cicatrización, hemorragia, infección, o inhibición suprarrenal.
También se puede usar nitroprusiato a dosis de 0,25 a 1 mcg/kg/min.
SHOCK SEPTICO
El paciente puede estar hipotenso, en shock profundo, oligúrico, acidótico y tener índice cardíaco normal o elevado y resistencia periférica baja, por los shunts arteriovenosos.
En fases más tempranas del curso clínico suele haber ausencia de efectos adrenérgicos con extremidades calientes y secas.
El efecto inflamatorio de las bacterias vivas sobre los tejidos y la probable producción de hormonas locales, facilitan la mezcla arteriovenosa o cortocircuitos fisiológicos; el efecto de esta mezcla es una mala utilización del oxígeno que condiciona el cuadro precedente.
Con la aparición de insuficiencia cardíaca la presión venosa central se eleva, lo que es un signo nefasto.
TRATAMIENTO
En el shock séptico hay que agregar otros tratamientos, control de la infección y eliminación de la fuente de contaminación bacteriana.
Para su tratamiento se utilizan: soluciones salinas (especialmente Ringer lactato),sangre o glóbulos rojos sedimentados, según necesidad, plasma, corticoides a dosis elevadas, antibióticos adecuados, a menudo diuréticos.
Los glucocorticoides inhiben la unión de la toxina al complemento, la administración de dosis farmacológicas de esteroides es controvertida, aunque se ha informado de mejorías en la función cardíaca, pulmonar y renal.
Se sabe que las dosis altas de esteroides tienen acción inotrópica moderada y producen vasodilatación periférica leve.
Se postula que estabilizan la membrana celular y lisosomal
Metilprednisolona 15 a 30 mg/kg, 1 o 2 dosis, o dexametasona 3 a 6 mg/kg E.V. Se repite en 2 a 4 hs si no se obtienen los efectos deseados.
Sin embargo, se corre el riesgo de la inmunosupresión que estas sustancias producen.
Fentolamina o fenoxibenzamina (Bloqueadores alfa, actualmente tienen interés histórico)
Los vasopresores alfa adrenérgicos son nocivos, producen aumento de la resistencia periférica por vasoconstricción.
Dopamina a dosis de 3 mcg/kg/min , tiene efecto vasodilatador (estimulante beta), actua sobre los receptores de dopamina, en la circulación mesentérica y renal, aumentando el flujo, por vasodilatación y disminuyendo la resistencia periférica total; pero a dosis mayores de 10 mcg/kg/min, ejerce efecto alfa nocivo.
La utilización de una bomba de balón intra-aórtica (IABP) ha demostrado su utilidad para salvar a algunos pacientes con lesiones miocárdicas. Durante la diástole, el inflado del balón vacía la aorta en dirección central, hacia las circulaciones coronaria y cerebral y periféricamente hacia las visceras abdominales.
Durante la sístole el ventrículo izquierdo expulsa la sangre hacia la aorta vacía; esta disminución de la post-carga disminuye el trabajo necesario para el vaciado del ventrículo izquierdo. asimismo se produce un vaciado más completo con lo que se disminuye la tensión de la pared y la demanda de oxígeno.
Disminuye en un 15 a 20 % el trabajo cardíaco y la demanda de oxígeno. Aunque al principio se utilizaba solo en el shock cardiogénico, la bomba de balón intra-aórtica o balón de contrapulsación, se emplea ahora en los casos de shock traumático y séptico grave.