La hipertensión en el sistema venoso portal puede ser inducida por varios procesos patológicos, la mayoría de los cuales probablemente hacen que se eleven las resistencias al flujo sanguíneo a través del hígado. El lugar donde ocurre este aumento de las resistencias ha proporcionado las bases para los esfuerzos encaminados a clasificar los diferentes tipos de hipertensión portal.
La obstrucción al flujo de salida venoso se ha denominado hipertensión portal post-sinusoidal o suprahepática. La producida por la cirrosis y por algunas otras enfermedades del parénquima hepático, se conoce como hipertensión portal intra-hepática, sinusoidal o postsinusoidal. La obstrucción del flujo de entrada portal se ha llamado hipertensión portal extrahepática, infrahepática o presinusoidal.
El lugar de la obstrucción venosa puede residir en el hígado,siendo por lo tanto intrahepática y ser al mismo tiempo postsinusoidal, como ocurre en la enfermedad venooclusiva, o ser sinusoidal (o postsinusoidal) como en la cirrosis, o ser presinusoidal como en la esquistosomiasis y en la esclerosis hepatoportal (hipertensión portal idiopática).
El aumento de la resistencia vascular en cualquier lugar del circuito portal ocasiona dilatación, estasis e hipertensión del lecho venoso esplácnico por detrás del hígado. Esto a su vez estimula el desarrollo de colaterales venosas que circunvalan la obstrucción hepática.
Anatomía patológica
Los sistemas colaterales más importantes son el sistema coronario-ácigos, causante de las varices esofágicas y esofagogástricas; el sistema umbilical de la pared abdominal, que pueden producir el síndrome de Cruveilhier-Baumgarten (venas colaterales muy grandes y tortuosas que se asocian con murmullo); las venas de Retzius, que representan conexiones portocavales en la región posterior o retroperitoneal; las venas de Sappey, que son conexiones entre la cara posterosuperior del hígado, el diafragma y el pericardio; y por último el sistema hemorroidal superior, medio e inferior, causante de las hemorroides internas y externas.
Aunque el volumen de sangre que llevan estas colaterales es, a veces, muy elevado, nunca puede quedar del todo aliviada la hipertensión portal, debido a que el estímulo para el desarrollo de estas colaterales es la misma hipertensión portal.
En el aspecto clínico existe una cierta correlación directa entre el tamaño de las varices esofágicas y el nivel de la hipertensión portal.
Algunos autores han postulado que la causa primaria de la hipertensión portal, al menos en algunas enfermedades, es una elevación del flujo arterial esplácnico, ya sea directamente, ya sea a través de cortos circuitos arteriovenosos en el bazo o en la submucosa del estómago y del intestino delgado.
A consecuencia de esta hipertensión, o asociada con la misma, es entonces que se congestionan la vías colaterales ya mencionadas, produciendose como vimos várices esofagogástricas que pueden ser causa de hemorragia.
Todavía es motivo de discusión si las hemorragias dependen de aumentos bruscos de la presión portal o si se deben a traumatismos o esofagitis péptica, o lo más probable a la combinación de más de una de estas causas.
La hipertensión portal, a consecuencia fundamentalmente de la hiperpresión vascular a nivel del sinusoide hepático, condiciona la aparición de ascitis.
El aumento de la presión a nivel del eje venoso portal, incrementandose de este modo la presión en la vena esplénica, condiciona un estasis venoso y secuencialmnente una congestión pasiva esplénica, que puede llevar a un hiperesplenismo. (Entendiéndose como tal el aumento de todas las funciones del bazo, que a su vez produce anemia, leucopenia y plaquetopenia)
El deterioro progresivo de la función hepática, puede llevar a la hiperamonemia, encefalopatía y coma hepático.
Clasificación de la hipertensión portal
Obstrucción presinusoidal
Extrahepática
Trombosis de la vena porta
1. Atresia congénita
2. Onfalitis neonatal
3. Pileflebitis (secundaria a sepsis intraperitoneal)
4. Estados de hipercoagulabilidad (policitemia, trombocitosis, anticonceptivos orales)
5. Estasis (cirrosis, deshidratación grave)
6. Traumatismos
7. lnflamaciones vecinas (pancreatitis, enterocolitis)
8. Obstrucción mecánica (tumores, adenopatías periportales, pancreatitis)
Intrahepática
Esquistosomiasis
Fibrosis hepática congénita
Esclerosis hepatoportal (hipertensión portal primaria)
Trastornos mieloproliferativos (enfermedad de Hodgkin, leucemia mieloide)
Sarcoidosis y enfermedad de Gaucher
Toxicidad por arsénico
Cirrosis biliar primaria
Obstrucción sinusoidal
Degeneración grasa
Hepatitis tóxica
Enfermedad de Wilson
Cirrosis
Obstrucción post sinusoidal
Intrahepática
Cirrosis
1. Nutricional (alcohólica)
2. Postnecrótica
3. Biliar secundaria
Hemocromatosis
Hepatitis viral
Hepatitis alcohólica
Síndrome de Budd-Chiari (intrahepático)
1. Enfermedad venooclusiva
2. Estados de hipercoagulabilidad (hemoglobinuria paroxística nocturna, anticonceptivos orales)
Extrahepáticas
Síndrome de Budd-Chiari (extrahepático)
1. Tabiques congénitos suprahepáticos de la cava
2. Neoplasias hepáticas, renales y suprarrenales
3. Traumatismos
4. Sepsis
Causas cardíacas
1. Pericarditis constrictiva
2. Insuficiencia cardíaca congestiva
Hipertensión portal por hiperflujo
Fístula arteriovenosa
1. Entre arteria hepática y vena porta
2. Esplénica
3. Mesentérica
Esplenomegalia masiva
Clasificación tomada de Zuidema Shackelford Enfermedades del aparato Digestivo 3ª Edición Editorial Médica Panamericana
En las formas obstructivas de la hipertensión portal, puede haber aumento también del flujo portal.
En general la hipertensión portal presinusoidal, no se asocia con alteraciones hepatocelulares graves, situación que si se observa en la postsinusoidal. Por ello ni la trombosis de la vena porta (Presinusoidal extrahepática), ni la esquistosomiasis (Presinusoidal intrahepática) producen alteraciones de la función hepática.
Por otra parte, la cirrosis es una afección hepatocelular primaria que se asocia con los tres tipos de obstrucción; el síndrome de Budd-Chiari produce disfunción hepática como consecuencia de la congestión hepática.
En relación con estas diferencias, el pronóstico de los pacientes con obstrucción sinusoidal y post sinusoidal tiende a ser peor que en los bloqueos presinusoidales.
Valoración basada en la fisiopatología
La diferenciación entre bloqueos presinusoidales y post sinusoidales depende de la medición de dos variables fisiológicas; la presión venosa portal (PVP) y la presión suprahepática enclavada (PSE).
La PVP puede medirse de diferentes formas; 1) por la inserción directa de
una aguja o catéter en la vena porta o en una de sus ramas colaterales durante una laparotomía; 2) por la introducción percutánea de un catéter en la pulpa esplénica;
3) por la cateterización de la vena umbilical y 4) por la inserción transhepática percutánea de un catéter en el lecho portal.
Cuando existe hipertensión sinusoidal o post sinusoidal, la PVP y la PSE se en-
cuentran elevadas, mientras que en la obstrucción presinusoidal la PSE es normal y la
PVP es elevada.
Fisiopatología
La presión portal normal es menor de 250 mm de H2O, con un valor medio de 215 mm de H2O y puede evaluarse como hemos visto por diversas técnicas.
En todos los casos de hipertensión portal, aumenta la presión de la pulpa esplénica, la presión suele ser 2-6mm Hg más alta que la presión de la vena porta misma.
Métodos auxiliares de diagnóstico
La manometría de la pulpa esplénica se lleva a cabo bajo anestesia local, pero está contraindicada en pacientes con tendencia a la hemorragia, trombocitopenia o ictericia intensa.
La esplenoportografía o la fase venosa de la arteriografía del tonco celíaco o de la mesentérica superior, define las características patológicas de la circulación portal.
Los estudios ayudan a demostrar venas colaterales, sobre todo várices esofagogástricas; también permiten la demostración gráfica del sitio de la obstrucción, es decir intrahepático o extrahepático.
Por lo general con esta técnica se puede definir la vena coronaria estomáquica que contribuye principalmente a las várices esofágicas.
EVOLUCION NATURAL
La hipertensión portal carente de complicaciones es asintomática.
Cuando se trata de un bloqueo presinusoidal, como sucede en la trombosis de la vena porta, la única causa de complicación letal es la hemorragia por várices. Dado que estos pacientes presentan una función hepática normal, el riesgo de muerte de cada episodio de hemorragia es del 5 al 10%, aun cuando exista hiperesplenismo.
El peligro de la hemorragia recurrente es grande.
En el bloqueo post sinusoidal determinado por afecciones de las venas suprahepáticas, el daño hepatocelular es secundario y depende de la congestión. En la fase aguda, estos pacientes pueden morir de insuficiencia hepática y, raras veces, por hemorragias varicosas. Si el paciente sobrevive a la fase aguda, se produce la regeneración y la fibrosis del hígado originando una cirrosis, con hipertensión portal y, por cierto, el riesgo de sangrado de las várices esofágicas.
El pronóstico para los pacientes con hipertensión portal secundaria a la cirrosis hepática depende, en forma principal, de la enfermedad de base. Entre los pacientes cirróticos con várices esofágicas demostradas, el 34% muere por hemorragias, el 32% fallece por insuficiencia hepática, el 11% muere por insuficiencia renal, el 9% por infecciones y el 14% por otras causas diversas.
Es importante saber que sólo el 50% de los pacientes cirróticos desarrollan várices esofágicas y sólo el 20% (la mitad de los que tienen várices) sangran a través de ellas.
También es interesante considerar que la hemorragia se produce dentro de los dos primeros años siguientes al diagnóstico de las várices en el 90% de los pacientes
que presentan esa complicación.
La muerte acompaña el episodio inicial entre el 30 y el 80% de los casos.
La supervivencia a 5 años, de los pacientes que han sangrado por várices, varía entre el 0 y el 35 %.
ESTUDIOS DIAGNOSTICOS
No existe una historia clínica que sea específica para el diagnóstico de hipertensión portal.
El único signo indicativo de esta condición es la presencia de la cabeza
de medusa. Los vasos colaterales de la pared abdominal, cuando están dilatados, forman la cabeza de medusa que se irradia desde el ombligo y manifiesta una dirección centrífuga de su circulación sanguínea.
Otros signos físicos sugieren la hipertensión portal pero no son diagnósticos, como la esplenomegalia, la ascitis, el estado de confusión y el temblor de la encefalopatía y las hemorroides.
La presencia de la hipertensión portal se anuncia, con frecuencia, por el desarrollo de hemorragia varicosa o de ascitis.
La enfermedad de las venas suprahepáticas, de tipo post sinusoidal, puede suceder también en ausencia de una afección hepatocelular, pero la ascitis masiva y el desarrollo de daño hepático debido a la congestión puede hacer más evidente el diagnóstico.
La cirrosis es la causa más frecuente de hipertensión portal. En consecuencia, los antecedentes de alcoholismo, hepatitis, exposición a hepatotóxicos o ictericía, así como los signos de palmas hepáticas, retracciones de Dupuytren, angiomas arácnidos, hipertrofia parotídea, ginecomastia, atrofia testicular, hepatoesplenomegalia, ascitis y temblores sirven para indicar que el paciente padece alguna afección hepática y que la hipertensión portal debe ser considerada.
Los métodos disponibles para la medición de la presión portal ya han sido citados al describir las diferencias entre bloqueos presinusoidales y post sinusoidales.
La causa más común es la cirrosis del hígado. En consecuencia, la función hepática debe ser bien estudiada. Las pruebas habituales de la funcionalidad hepática: seroalbúmina, bilirrubina sérica, tiempo de protrombina y las que sugieren la necrosis hepática activa (aspartato-aminotransferasa [AST], alanino-aminotransferasa [ALT] y lactato-dehidrogenasa [LDH]). En la obstrucción presinusoidal esas pruebas tienden a expresar resultados normales, mientras que en el síndrome de Budd-Chiari suele haber una concentración elevada de fosfatasa alcalina, cierta elevación de la bilirrubina y ligeras anormalidades de las otras pruebas funcionales hepáticas, asociadas con una
ascitis masiva y hepatomegalia.
Se debe considerar la posibilidad de efectuar una biopsia hepática toda vez que exista una duda razonable.
Las complicaciones de la hipertensión portal son la ascitis, la encefalopatía, el hiperesplenismo y las várices esofágicas. La ascitis suele ser detectada durante el examen físico
La encefalopatía debe sospecharse en presencia de confusión y temblores. Este diagnóstico, que luego puede ser confirmado con la determinación de amonio en sangre y electroencefalograma.
Al hiperesplenismo se lo puede identificar por el recuento de plaquetas y otros estudios hematológicos.
La complicación establecida por la presencia de várices esofágicas, pueden determinar hemorragias espectaculares y constituyen la indicación más común para la intervención quirúrgica.
El estudio inicial de las várices esofágicas se realiza mediante radiología complementada con la ingesta de una lechada de bario, tiene una exactitud que llega sólo al 60% y puede ser aumentada si se utiliza la cinerradiografía, las maniobras de Valsalva.
La esofagoscopía realizada con un fibroscopio posee una exactitud entre el 70 y el 97%; puede documentar no sólo la presencia de las várices sino también la existencia de hemorragia originada en ellas.
Permite demostrar la presencia de otras causas frecuentes de hemorragia alta, como la esofagitis, los desgarros de Mallory-Weiss y la gastritis.
Además, existen cuatro técnicas angiográficas para el diagnóstico de las várices esofágicas: La más antigua de ellas es la esplenoportografía, que se realiza mediante la introducción de una aguja en la pulpa esplénica; este abordaje permite la determinación de la presión de la pulpa esplénica y la estimación de la presión portal libre.
Otro método directo de introducir material de contraste angiográfico en el sistema portal es la portografía umbilical.
La canalización de la vena umbilical permite no sólo la portografía, sino la medición de la presión portal así como la introducción de diversos agentes farmacoló-gicos en el lecho portal
El abordaje más reciente para el diagnóstico de las várices esofágicas es la portografía percutánea transhepática.
La fase venosa de la arteriografía, suele ser, en la actualidad, la técnica de uso más frecuente para demostrar las várices esofágicas y para estudiar la circulación venosa portal.
Existen otros estudios que, en algunas ocasiones, pueden ser de utilidad en el estudio de
la hipertensión portal. El venograma suprahepático enclavado hace posible observar detalles de la morfología sinusoidal.
La arteriografía también puede ser útil. El arteriograma hepático muestra típicos cambios en la cirrosis y puede demostrar la presencia de otra patología asociada, como el hepatoma. La arteriografía del tronco celíaco y de la mesentérica superior también puede identificar la fuente de una hemorragia digestiva alta, diferente de las várices
esofágicas.
Los estudios con radioisótopos. Los rastreos hepáticos con radioisótopos, en general realizados con sulfuro colodial de 99Tc muestran los cambios difusos típicos de la cirrosis y también pueden evidenciar defectos localizados.
Existe un interés creciente por la determinación del flujo sanguíneo hepático y para ello se han descrito diversos métodos, muchos de los cuales se utilizan con cana-
lizaciones de las venas suprahepáticas o con técnicas radioisotópicas.
La punción biopsia de hígado puede ser muy útil.
TRATAMIENTO DE URGENCIA MEDICO Y QUIRURGICO DE LAS VARICES ESOFAGICAS SANGRANTES
De las cuatro complicaciones importantes de la hipertensión portal, sólo la hemorragia por várices esofágicas puede convertirse en un problema de urgencia.
El tratamiento médico de la hipertensión portal, por sí mismo, es el de la
enfermedad de base, en general la cirrosis hepática.
El paciente con disrrupción varicosa se presenta con hemorragia digestiva alta y el primer paso consiste en realizar el diagnóstico específico.
La localización precisa de la hemorragia requiere la ejecución de alguno de los
procedimientos diagnósticos ya mencionados.
En situación de urgencia no son apropiados los estudios radiológicos con bario, primero por que esos estudios no pueden descubrir otras causas de hemorragia digestiva alta, como el síndrome de Mallory-Weiss o la gastritis, y segundo, porque la presencia de bario interfiere con la endoscopia y la arteriografía. El enfoque inicial debe ser la esofagogastroduodenoscopía. En todo caso, antes de realizar este estudio se debe evacuar el contenido de sangre y coágulos del estómago con lavados profusos con solución salina enfriada a través de un grueso tubo nasogástrico. Si la hemorragia masiva impide la endoscopia, el enfoque alternativo es la angiografía selectiva del tronco celíaco, de la arteria esplénica y mesentérica superior.
La angiografía puede demostrar la presencia de una arteria sangrante siempre que el escape de sangre supere los 6 ml/min.
Aunque la arteriografía puede fracasar en el intento de demostrar la pérdida de sangre por las várices puede, por cierto, mostrar esas alteraciones y eliminar otras posibles fuentes. Por otra parte, cuando existe una hemorragia exsanguinante, lo más apropiado será instituir las medidas de urgencia para el control de la hemorragia masiva dejando para más tarde la determinación de la etiología causal.
TRATAMIENTO MEDICO DE SOSTEN Y LAVADO
El paciente cirrótico con hemorragia por várices esofágicas sufre una enfermedad grave con múltiples manifestaciones tardías. Estos pacientes mueren, muchas veces, más por insuficiencia hepática, insuficiencia renal o infecciones que por la exsanguinación. De acuerdo con ello, el tratamiento médico de sostén es crítico para la supervivencia. La primera prioridad es el remplazo rápido del volumen sanguíneo,
al principio con cristaloides y luego, tan pronto sea posible, con sangre total. Se debe tener cuidado en evitar la administración de líquidos que contengan demasiada sal porque existe una ávida retención de sodio.
La sangre administrada debe ser lo más fresca posible a fin de reemplazar los factores de coagulación que se han perdido, evitar la formación de amonio, que se produce en la sangre almacenada. La restauración del volumen sanguíneo debe ser controlada mediante una sonda de Foley vesical y con el control de la presión venosa central, sea por un catéter en la vena cava o con uno de Swan-Ganz.
La prevención de la encefalopatía requiere la eliminación de la sangre del estómago y del colon con lavados y enemas, respectivamente. La evacuación intestinal se promueve con la instilación de citrato de magnesio a través de la sonda nasogástrica.
Se retarda la producción de amonio en el colon utilizando neomicina o lactulosa, ambas por la sonda nasogástrica y por enemas.
La insuficiencia hepática necesita el sostén aportado por la administración intravenosa de soluciones hipertónicas de glucosa que contengan vitaminas B y C, junto con la administración parenteral de vitamina K.
El tratamiento inicial de la hemorragia digestiva alta con soluciones o agua enfriada es
una práctica de aplicación casi universal.
TRATAMIENTO FARMACOLOGICO
La vasopresina es el fármaco que se utiliza con más frecuencia en el control de la hemorragia por várices esofágicas.
Se usa por vía intravenosa a razón de 20 unidades (en bolo) en 500 ml de solución glucosada, o por infusión continua.
Se utilizó también vasopresina a través de un catéter ubicado en la arteria mesentérica superior.
El cese inicial no es sinónimo de supervivencia y la hemorragia puede recidivar.
El uso de vasopresina no está exento de complicaciones: hipertensión, bradicardia, arritmias cardíacas, edema agudo de pulmón, infarto de miocardio y retención acuosa grave.
Vasopresina, proporciona un control transitorio de la hemorragia varicosa y
no produce mejorías en lo referente a la supervivencia prolongada. La velocidad inicial de infusión es de 0,4 unidades/min, que puede ser aumentada hasta 0,9 unidades/min.,
luego, la velocidad de la infusión se reduce.
Este procedimiento puede detener una hemorragia varicosa durante el tiempo suficiente para colocar el balón de Sengstaken-Blakemore.
Se han utilizado otras drogas junto con la vasopresina con el intento de controlar sus efectos colaterales: El nitroprusiato de sodio, la nitroglicerina, que se administra por vía intravenosa, sublingual o transdérmica.
La vasopresina también ha sido utilizada en forma intraoperatoria para reducir el sangrado de las várices durante la ejecución de las derivaciones portosistémicas.
En el momento actual se están usando otras drogas destinadas al control farmacológico de la hemorragia por várices esofágicas, la más promisoria es la somatostatina
La terapéutica farmacológica se ha utilizado también para la prevención alejada de esa complicación. El propranolol es la droga que se utiliza en forma profiláctica.
TAPONAMIENTO CON BALON
El taponamiento con balón ha llegado a ser el método más utilizado para el control transitorio de la hemorragia varicosa.
La colocación del balón de Sengstaken-Blakemore debe ser realizada en forma
minuciosa si se desea evitar graves complicaciones. El pasaje nasal y por la nasofaringe debe efectuarse luego de una prolija anestesia con agentes tópicos. Una vez que el tubo se encuentra alojado en el estómago se procede a lavar ese órgano con agua helada para eliminar la sangre y los coágulos. Se infla el balón gástrico con 50 ml de aire y se obtiene una radiografía que asegura su correcta posición en el estómago.
Una vez seguro de ello, se agregan 250 ml de aire al balón gástrico para, luego, cerrar en forma segura la vía que lo drena. Se tracciona del tubo hasta sentir que el balón apoya en la unión gastroesofágica y entonces se lo fija.
En estas condiciones el paciente queda impedido para deglutir por lo que se de-
be establecer una aspiración del esófago por encima del balón gástrico, esta maniobra reduce el riesgo de la neumonitis aspirativa.
Con en el tubo en su lugar y el balón gástrico inflado, la hemorragia debe interrumpirse tal como se puede establecer por el lavado gástrico y la aspiración esofágica. Si ello no ocurre, se puede inflar el balón hasta con 450 ml de aire.
Si a pesar de ello la hemorragia continúa, se infla el balón esofágico a una presión de 35 mm de Hg. La persistencia de la hemorragia indica que este tratamiento es infructuoso.
Una vez que la hemorragia se ha detenido se deja el balón en posición durante 24 horas. Al terminar ese lapso se desinfla el balón esofágico y a las 24 horas siguientes el gástrico.
El uso de los tubos de Nachlas o de Linton es similar con la excepción de que ambos tienen sólo un balón, el gástrico.
ESCLEROTERAPIA ENDOSCOPICA
La técnica de la escleroterapia endoscópica, descrita en 1939, es el enfoque no operatorio más apreciado para el tratamiento de las varices esofágicas. Su importancia ha alcanzado un nivel tan alto como para constituirse en el procedimiento inicial definitivo de elección, tanto para la urgencia como para el tratamiento electivo de las várices esofágicas sangrantes.
TRATAMIENTO QUIRURGICO
LIGADURA DE LAS VARICES
La ligadura de las várices es un procedimiento de urgencia para el control de las hemorragias agudas que fue introducido por Boerema y Crile, ha sido suplantada en la actualidad, por la escleroterapia endoscópica.
La incidencia de la hemorragia recurrente era del 28 al 83%, a menos que se efectuara luego una anastomosis portosistémica.
SECCION DEL ESOFAGO
La sección del esófago distal, propuesta primero por Walker, fue mejorado con el uso del «botón» mecánico de Boerema.
La innovación más reciente de la técnica de la sección esofágica es el uso de los aparatos de suturas mecánicas, el aparato EEA es el que se utiliza con mayor fre-
cuencia. La técnica para el uso de este último instrumento consiste en exponer el esófago a través de una incisión subcostal izquierda. Se expone la unión gastroesofágica separando el lóbulo izquierdo del hígado. Se movilizan los últimos 3 cm del esófago.
se realiza una gastrotomía vertical alta, a continuación se introduce el equipo EEA en
el esófago inferior utilizando el cartucho de mayor tamaño posible (en general, de 28 mm).
El cartucho y el yunque se separan para permitir que la zona por abrochar se encuentre en la parte liberada del esófago. Se ajusta con firmeza la hebra de Prolene que rodea el esófago contra el vástago central. Se ajusta también el equipo y luego de proceder a su disparo se lo extrae con cuidado utilizando un suave movimiento de rotación. Se deben controlar el cartucho y el yunque para asegurar que se ha extirpado una rosca que incluya todas las capas del esófago. La gastrotomía se cierra con una sutura en dos planos. El paso final de la operación es la identificación y ligadura en varios lugares de la vena coronaria.
DERIVACIONES PORTOSISTEMICAS
Existen numerosas técnicas de derivación portosistémica. La mayoría de ellas no son utilizadas en condiciones de urgencia. Sin embargo, sólo tres de ellas se han utilizado para controlar la hemorragia por várices esofágicas, en condiciones de urgencia: el shunt portocava término-lateral, el látero-lateral y el shunt mesocava con injerto en H.
La incidencia general de la encefalopatía entre estos pacientes con prolongada supervivencia llega al 18%. El shunt portocava de urgencia tiene una mortalidad operatoria general del 44% aproximadamente.
SELECCION DE LOS PACIENTES E INDICACIONES PARA, EL TRATAMIENTO
QUIRURGICO
En cualquier paciente cirrótico con hipertensión portal, la realización de una operación, en especial el shunt portocava, ha sido considerada desde hace mucho tiempo como portadora de un significativo riesgo de muerte. Esas operaciones también se asocian con la posibilidad alejada de morbilidad, como la encefalopatía e insuficiencia hepática progresiva.
De acuerdo con ello, se han establecido diferentes criterios para predecir los riesgos quirúrgicos y el desarrollo final de la encefalopatía y de la insuficiencia hepática, así como también la probable supervivencia prolongada.
Criterios clínicos de selección
Desde el principio se reconoció que el paciente con ictericia, ascitis y encefalopatía era un candidato para la operación de peor calidad que el paciente que no presentaba esas complicaciones. También ha resultado claro que en condiciones de urgencia, las operaciones presentan mayores riesgos que las electivas.
Child publicó su clasificación basada en el estudio de la función hepática y en los signos clínicos, que desde entonces ha logrado aceptación general. Esta clasificación define 3 grupos de pacientes en base a la alteración leve, moderada y grave de la función hepática.
A pesar de su continua popularidad, la clasificación de Child ha sido criticada por dos razones: 1) omite ciertas características de la cirrosis que se consideran importantes, y 2) la asignación de un paciente a un grupo determinado puede resultar algo arbitraria.
Se ha encontrado que la presencia de necrosis hepática activa, en especial en la hepatitis alcohólica aguda, y en menor extensión en la hepatitis crónica activa, aumenta la mortalidad quirúrgica. En consecuencia, la posibilidad de la existencia de una afección hepatocelular activa debe ser establecida en el preoperatorio con los estudios enzimáticos, en especial la AST, ALT y LDH. La hepatitis crónica activa puede ser reconocida con las preparaciones para células del lupus eritematoso (LE), anticuerpos antinucleares, anticuerpos contra las fibras musculares lisas y dosaje del nivel de complemento en suero. Este último puede estar disminuido y todos los otros elevados. Si todavía persisten dudas razonables, se deberá efectuar una punción biopsia hepática.
En el momento actual, parecería que los mejores criterios de selección clínica, son los descriptos por Child, con el agregado del dosaje de transaminasas.
Clasificación clínica y de laboratorio de los pacientes con cirrosis, en términos de reserva funcional hepática
| Clasificación | |||
| Criterios | Bueno A | Moderado B | Malo C |
| Bilirrubina Sérica (mg/100 ml)Seroalbúmina (g/100 mlAscitisEncefalopatía
Nutrición |
Menos de 2,0Más de 3,5NoNo
Excelente |
2,0 – 3,03,0 – 3,5De fácil controlMínima
Buena |
Más de 3,0Menos de 3,0Mal controladaAvanzada, «coma»
Mala, «emaciación» |
Adadptado de Child C.G. III and Turcone J.G.: Surgery and Portal Hypertension. En Child C.G. III The Liver and Portal Hypertension. Filadelfia. W.B. Saunders 1964 p. 50.
Estudios prospectivos controlados han demostrado que el shunt portocava profiláctico, indicado por la sola presencia de las várices esofágicas no es efectivo para prevenir la hemorragia de origen en dichas várices.
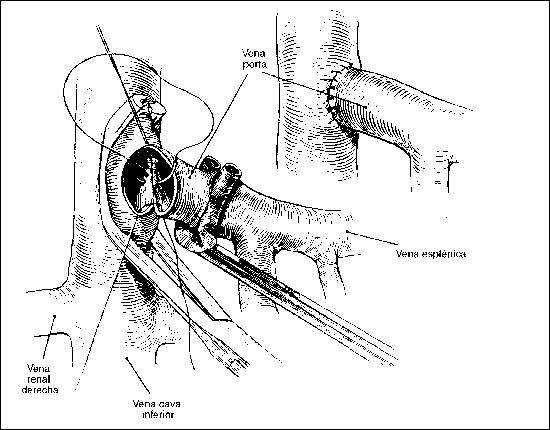
SHUNTS PORTOCAVAS
Shunt portocava término-lateral. Se han colocado puntos de tracción en los ángulos y se está confeccionando el plano posterior de la anastomosis. Se puede observar el uso del clamp de Blalock sobre la vena porta. El shunt terminado se muestra arriba y a la derecha. (Tomado de Zuidema G. D., Cameron J. L. and Zeppa R.: Portal hypertension, II: Operative procedures. En Nora P. F.: Operative Surgery: Principles and Techniques. Filadelfia, Lea & Febiger, 1980, p. 649.)
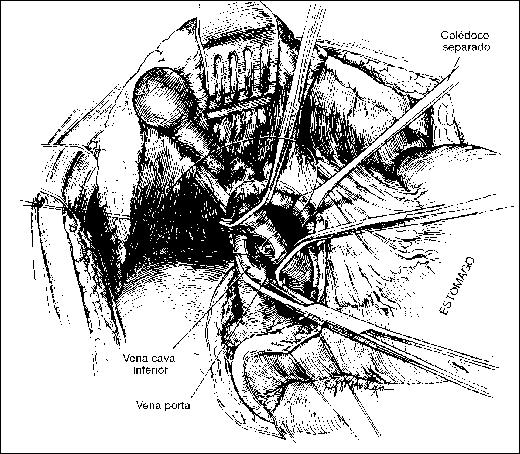
Técnica de la anastomosis portocava laterolateral modificada
Tomado de P. F. Nora. Cirugía General Principios y Tecnicas 2ª Ed. Salvat
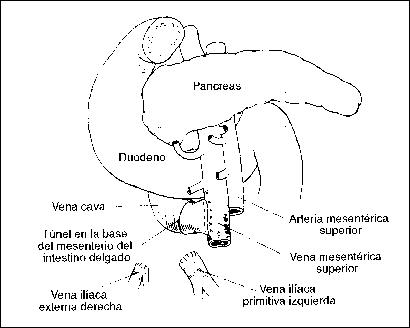 Shunt mesocava directo. Relaciones de la anastomosis terminada
Shunt mesocava directo. Relaciones de la anastomosis terminada
Con el duodeno y el páncreas. Zuidema Cirugía del aparato Digestivo
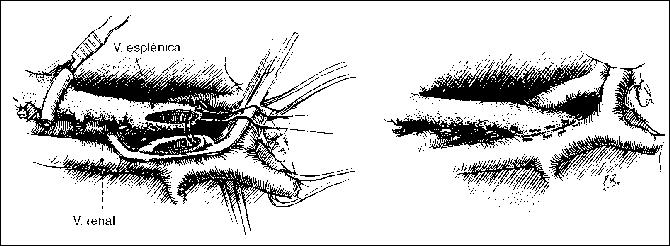
Primer punto de la sutura continua eversora para la anastomosis terminolateral entre la vena esplénica y la renal.
En la figura de la derecha se presenta la anastomosis completada Tomado de Nora P.F. 2ª Edición
 Representación esquemática de una anastomosis esplenorenal distal
Representación esquemática de una anastomosis esplenorenal distal
OPERACIONES SIN SHUNT
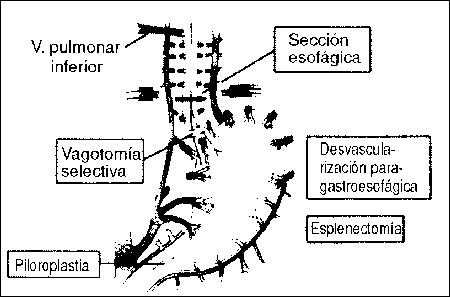
Operación de Sugiura Tomado de Sugiura and Futagawa
Arch Surg 112: 1317, 1977
Excelente informacion, sigue asi!