LESIONES QUIRÚRGICAS DE LAS VÍAS BILIARES
CÁNCER DE PAPILA (presentación)
PATOLOGÍA BILIAR BENIGNA (Presentación)
CÁNCER DE LAS VÍAS BILIARES
CANCER DE LA VESICULA BILIAR
El cáncer de la vesícula es un tumor de alta malignidad, que infiltra precozmente los tejidos vecinos y que es imposible de curar salvo cuando es encontrado como carcinoma in situ, en el cual no hay invasión del estroma, siendo estos casos hallazgos de anatomía patológica en vesículas extirpadas por otros procesos. Este tumor es bastante raro, (3% a 4% de los carcinomas del aparato digestivo) representa un 85 a 90% de todos los tumores primarios de la vesícula.
Las mujeres se afectan con una frecuencia 3 a 4 veces mayor que los hombres y su incidencia aumenta con la edad; las tres cuartas partes de los pacientes tienen más de 60 años.
Etiopatogenia
Algunos consideran como enfermedad preneoplásica a los adenomas y papilomas aunque no todos los autores están de acuerdo.
Se acepta en cambio generalmente, que la litiasis vesicular puede ser un factor etiológico, ya que acompaña a las neoplasias en el 80 al 90% de los casos. Inversamente, el cáncer vesicular se hace presente en aproximadamente el 2% de las vesículas extirpadas por litiasis, aceptándose que el proceso empezaría como una hiperplasia inducida por la presencia de los cálculos, que se transformaría después en un carcinoma in situ
La hialinocalcinosis, (vesícula en porcelana) presenta degeneración carcinonatosa en el 10% de los casos, por lo cual la mejor profilaxis del cáncer en estos procesos, es la colecistectomía precoz.
Existe además, una mayor incidencia de esta neoplasia en trabajadores del caucho
ANATOMIA PATOLOGICA
Localización
Puede estar ubicado en el cuerpo de la vesícula, en el fondo y en el 4% de los casos el tumor se origina en el cístico.
La pared se presenta engrosada, de color gris blanquecino, de consistencia dura.
El 80% de los casos son adenocarcinomas y el resto son tumores indiferenciados o de células escamosas.
De los adenocarcinomas 70 % son escirros, 20 % son papilares y 10 % son mucoides.
Diseminación
Contigüidad
La modalidad de propagación más común es la invasión directa: el compromiso del parénquima hepático limítrofe es casi constante pero también pueden estar tomados el estómago, duodeno, colon, páncreas y pared abdominal anterior.
El cístico y la vía biliar principal son invadidos con frecuencia, con la consiguiente obstrucción biliar.
Vía linfática
La difusión linfática afecta temprano a los ganglios linfáticos císticos y hepatocoledocianos y después a los pancreatoduodenales hasta llegar, por último, a los celíacos, mesentéricos superiores y aórticos. En el 25% de los casos están tomados los ganglios linfáticos retroperitoneales.
Vía venosa
Bastante comunes son las metástasis hepáticas, que se cumplen por la vía venosa afluente de la porta.
Exteriorización peritoneal
El 20% de los pacientes tienen metástasis peritoneales, mientras que el compromiso de otros órganos intraabdominales es menos frecuente.(Epiplones, peritoneo visceral, fondo de saco de Douglas)
Vía neural
Es otra de las vías de diseminación que se describe en el carcinoma de la vía biliar.
MANIFESTACIONES CLINICAS
Los signos y síntomas del carcinoma vesicular son superpuestos a los que producen la colecistitis y la colelitiasis.
La mayoría de los pacientes presentan malestar abdominal, dolor epigástrico y en el cuadrante superior derecho, náusea y vómito. Cerca de la mitad tienen ictericia, por invasión y obstrucción de la vía biliar principal, hepatomegalia, cuadro doloroso continuo en hipocondrio derecho y en dos tercios hay una masa palpable en el cuadrante superior derecho, correspondiente a tumor vesicular.
Náuseas, vómitos y pérdida de peso, acompañados de anemia y en casos avanzados se pueden palpar nódulos en el reborde hepático.
Los datos de laboratorio son de poca ayuda. Puede existir leucocitosis, neutrofilia en las colecistitis con empuje agudo o linfocitosis en las crónicas, la eritrosedimentación puede estar más o menos acelerada. Las pruebas de funcionamiento hepático pueden ser diagnósticas de ictericia obstructiva, si la hubiere (hiperbilirrubinemia, fosfatasa alcalina elevada, transaminasas y gamma glutamil transpeptidas con valores levemente aumentados).
Diagnóstico por imágenes
La vesícula por lo general se visualiza con paredes engrosadas en la ecografía, pueden observarse adenopatías, metástasis hepáticas e infiltración de otros órganos, si existe obstrucción del cístico la vesícula se verá dilatada y cuando infiltra la vía biliar principal puede dar dilatación de la vía biliar intra y extra hepática.
Estos mismos hallazgos arroja la tomografía axial computada y la resonancia magnética nuclear (con un costo algo mayor) y se puede corroborar la dilatación de la vía biliar, por colangiografía endoscópica retrógrada (ERCP) o por colangiografía transparieto hepática, que revelan el exacto nivel de la obstrucción cuando existe.
En muchos pacientes se encuentra el carcinoma vesicular en forma incidental durante una colecistectomía común.
Terapéutica
El carcinoma de la vesícula biliar ya está avanzado en el momento del diagnóstico en el 75% de los casos. Sin embargo, si no hay compromiso neoplásico evidente de otros órganos y, además, la propagación linfática se limita a los primeros grupos ganglionares, la infiltración del parénquima hepático no contraindica la intervención quirúrgica. Si, la difusión intrahepática está limitada al lecho de la vesícula e incluso a una zona limítrofe, con la resección hepática se puede eliminar debidamente el tejido neoplásico. El tratamiento quirúrgico ofrece la única posibilidad de curación, aunque ésta es pequeña.
La lobectomía derecha ampliada está indicada raras veces porque es improbable que el compromiso del hígado sea tan masivo sin que también estén tomados los elementos hiliares o los que transcurren por el epiplón menor.
En estos casos la indicación de intervenciones resectivas es muy discutible porque siempre son muy complejas en la fase reconstructora y porque sus resultados finales no justificarían los riesgos operatorios.
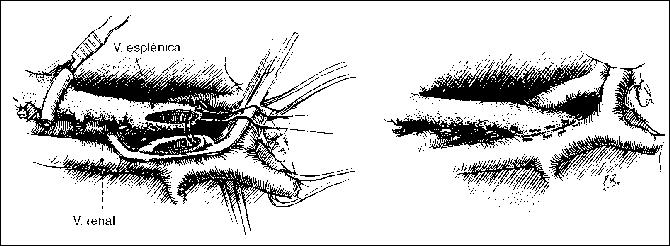
Si el carcinoma es un hallazgo ocasional de la colecistectomía hay que establecer el grado de infiltración parietal en el intraoperatorio realizando un examen histopatológico y si la invasión neoplásica ha superado la pared de la vesícula hay que resecar el parénquima del hígado hasta obtener un margen sano de por lo menos 2,5 a 3 cm en torno del sitio de la infiltración. En principio esta resección comprende el segmentos V y porción anterior del segmento IV.
En toda intervención realizada con intención curativa se debe hacer una linfadenectomía regional. Los grupos ganglionares que se deben incluir en la disección son los del hilio y del ligamento hepatoduodenal a lo largo del eje hepatocoledociano, de la arteria hepática y del tronco portal hasta la región duodenopancreática. Las disecciones deberían llevarse hasta el tronco celíaco. Debe ser también extirpado el ligamento redondo y suspensorio.
Las intervenciones de derivación biliar están indicadas en pacientes con ictericia obstructiva o en caso de riesgo inminente de obstrucción. Conviene delimitar con reparos metálicos la neoplasia para un eventual tratamiento radioterápico.
Sin embargo con este enfoque no ha mejorado la tasa de sobrevida a cinco años, la misma se acerca al 2%.
Noventa por ciento de los pacientes fallecen antes del año. En caso de un tumor confinado a la mucosa y la submucosa, se ha notificado una tasa de sobrevida de 64 por ciento.
CARCINOMA DE LA VIA BILIAR PRINCIPAL
Anatomía patológica.
El adenocarcinoma es el histotipo más frecuente. La incidencia es mayor en los hombres que en las mujeres (relación 3:2). Se encuentra en las necropsias con una frecuencia de alrededor de 0,3% y en alrededor del 1% de las operaciones sobre las vías biliares.
Su presentación es más frecuente en el sexto y séptimo decenio de la vida. Además se ha encontrado este tumor en el 0,5 % de los pacientes con colitis ulcerosa.
La localización más habitual es en el hepático común o en la convergencia de ambos hepáticos y los carcinomas del segmento distal del colédoco son difíciles de diferenciar de los de la cabeza del páncreas. Son raras las metástasis a distancia.
En frecuencia, le sigue al cáncer de páncreas como causa de obstrucción maligna de la vía biliar.
Desde el punto de vista topográfico las neoplasias pueden originarse a cualquier altura del árbol biliar. Las nacidas en los conductos intrahepáticos se agrupan con los tumores del hígado y las del tercio inferior resultan muchas veces difíciles de diferenciar clínicamente, del cáncer de la cabeza del páncreas.
Macroscópicamente se presentan bajo formas diferentes: nodular, estenosante o en virola, infiltrante o vegetante.
En cuanto a su clasificación histológica son en su gran mayoría adenocarcinomas con diversos grados de diferenciación, y en raras oportunidades otros tumores como leiomiosarcomas, fibrosarcomas, o melanomas. Los adenocarcinomas presentan, como característica particular, escasa celularidad e intensa reacción fibrosa y son de crecimiento lento. Los conductos biliares extrahepáticos poseen una abundante red linfática, las metástasis a los ganglios linfáticos regionales ocurren tempranamente; la vena porta y con menos frecuencia, la arteria hepática se afectan por contigüidad en las neoplasias del tercio medio y superior.
Las metástasis en otros órganos se observan en el 21 % de las autopsias.
Una variedad de estos tumores es el llamado «carcinoma esclerosante» (tumor de Klatskin), que se ubica en el confluente biliar superior y es de lenta evolución.
Las neoplasias del tercio inferior comprometen el páncreas y más tardíamente el duodeno.
Etiopatogenia y epidemiología. La etiología del cáncer de la vía biliar permanece aún desconocida.
Los ácidos biliares son estructuralmente semejantes al metilcolantreno, conocido agente carcinogenético. El ácido desoxicólico demostró propiedades inductoras de neoplasias en la experimentación animal.
La fibrosis hepática congénita y anomalías congénitas como los quistes de colédoco y la colangitis esclerosante parecen constituir un factor predisponente al carcinoma de la vía biliar.
Existe también una asociación de presentación con algunas parasitosis como el Clonorchis sinensis y el Opisthorchis felineus o viverrini en paises sudasiáticos, donde estos tumores son más frecuentes.
Se ha interpretado que la estasis biliar predispone a la degradación bacteriana de los ácidos biliares y a la activación de componentes carcinogéneticos.
Ya ha sido puesta de relieve la relación del cáncer de la vía biliar con la colitis ulcerosa. (el cáncer biliar se observa a una edad promedio menor en los portadores de colitis ulcerosa).
Fisiopatología.
El crecimiento de un tumor en la vía biliar produce una obstrucción progresiva que genera hipertensión biliar en el sector proximal respecto de la neoplasia, lo cual se manifiesta por una dilatación de la vía biliar supratumoral extrahepática e intrahepática.
La dificultad al pasaje de bilis en las obstrucciones incompletas o cuando el tumor compromete uno solo de los conductos hepáticos a nivel del confluente (hipertensión biliar segmentaria) explica la elevación de los valores de fosfatasa alcalina, la cual se detecta a veces antes del ascenso de la bilirrubina.
Cuando el tumor se halla en el tercio inferior de la vía biliar, participa distendiéndose la vesícula biliar. Una vesícula palpable, al igual que en el cáncer de la cabeza del páncreas, constituye el signo de Bard y Pic.
Cuando el tumor se ubica sobre la desembocadura del cístico, también puede producir una vesícula palpable.
El compromiso de las estructuras vasculares del pedículo hepático no tiene repercusión clínica pero condiciona la resecabilidad y descarta la cirugía de intención curativa del proceso.
Cuadro clínico
Las manifestaciones fundamentales son ictericia, acolia, coluria y prurito.
El síndrome de obstrucción biliar es generalmente de instalación lenta, se observa además, deterioro del estado general y pérdida de peso.
El dolor en el hipocondrio derecho o el epigastrio puede estar presente hasta en el 60 % de los casos, pero no tiene características de cólico y su intensidad es variable. El prurito acompaña generalmente al cuadro clínico en sus etapas avanzadas, pero también puede constituir un síntoma inicial.
En estadios avanzados la infección biliar parece ser un hecho frecuente, especialmente en pacientes operados, lo cual se evidencia por el número de microabscesos hepáticos que se encuentran en los estudios de necropsia.
La hepatomegalia es frecuente, y en las obstrucciones bajas puede palparse la vesícula biliar.
Métodos complementarios de diagnóstico
Los exámenes de laboratorio definen el carácter extraparenquimatoso de la obstrucción biliar. Se detecta elevación de los valores de bilirrubina con predominio de la fracción conjugada, del colesterol y de la fosfatasa alcalina. Esta última puede manifestarse durante el período preictérico. En pacientes anictéricos, una elevación de la fosfatasa alcalina no justificada por otra patología ha inducido a realizar colangiografía transparietohepática y a encontrar una neoplasia del confluente.
El diagnóstico positivo de obstrucción biliar se hace por ecografia y la tomografia axial computada, que permiten afirmar el carácter obstructivo de la ictericia al demostrar la dilatación del árbol biliar intrahepático.
El nivel de la obstrucción a veces también puede sospecharse cuando se visualiza la vía biliar extrahepática. Una franca dilatación de los canalículos intrahepáticos con colédoco normal y vesícula fláccida es el hallazgo ecográfico característico de los tumores altos de la vía biliar. En esta etapa, la ecografia es el procedimiento de elección por ser más sencillo, inocuo y de menor costo.
Ambos métodos completan el estudio del paciente ya que permiten detectar metástasis hepáticas o patología asociada en otros órganos abdominales.
Diagnóstico topográfico de la obstrucción biliar
La colangiografía retrógrada por fibroduodenoscopia y la colangiografia transparietohepática con aguja fina permiten visualizar la altura y el grado de obstrucción, y también las características morfológicas de ésta.
La vía trasparietohepática, fundamentalmente en las obstrucciones completas muestra los detalles del nivel superior de la lesión y el compromiso o no de ambos hepáticos, lo cual es útil para la elección del procedimiento quirúrgico.
Diagnóstico anatomopatológico preoperatorio
Es dificil llegar a un diagnóstico anatomopatológico previo a la cirugía.
La determinación de antígeno carcinoembrionario en la bilis obtenida por punción trasparietohepática y el estudio citológico de este material pueden obtener algún porcentaje de diagnósticos positivos. La punción biopsia por aspiración con aguja fina mediante guía colangiográfica (trasparietohepática) ha resultado útil en el 53 % de los casos, pero es un procedimiento complejo.
El diagnóstico anatomopatológico es difícil en los tumores de la vía biliar principal, aun durante el acto quirúrgico. El problema radica en la escasa celularidad y la intensa reacción fibrosa de estas neoplasias, que a menudo hacen infructuosas las biopsias por congelación. En oportunidades es posible extraer material para estudio mediante curetaje por dentro de la luz coledociana. Es conveniente efectuar un estudio por congelación de cualquier ganglio vecino con aspecto patológico.
Presenta dificultades la diferenciación entre un tumor del colédoco intrapancreático y un cáncer de la cabeza del páncreas o de la régión ampular, porque el origen embriológico común, hace que reproduzcan imágenes histológicas semejantes.
En las obstrucciones altas el diagnóstico diferencial deberá hacerse con un carcinoma de vesícula biliar o con compresiones de origen ganglionar.
Si el paciente tiene el antecedente de una operación previa sobre las vías biliares, también deberá tenerse en cuenta una posible estenosis por lesión quirúrgica de la vía biliar.
Librado a su evolución natural, el cáncer del hepatocolédoco lleva a la muerte por obstrucción biliar e insuficiencia hepática, más que por la diseminación neoplásica. Sin tratamiento, los pacientes generalmente no superan los cuatro meses de vida.
La infección acelera el proceso instalándose una colangitis que puede evolucionar hacia la formación de abscesos hepáticos.
El cuadro séptico caracteriza el final de estos pacientes, que pueden presentar, además; hemorragias digestivas, insuficiencia renal o neumopatías terminales.
Tratamiento.
Se tratarán los eventuales trastornos de la coagulación y si estuviera presente, la infección biliar.
Aunque comúnmente los carcinomas de los conductos biliares siguen una evolución lenta y a menudo todavía se hallan relativamente limitados en el momento del diagnóstico, las íntimas relaciones anatómicas con las importantes estructuras limítrofes disminuyen mucho las posibilidades quirúrgicas. La resección es el tratamiento de elección
La laparotomía estará indicada para intentar un procedimiento resectivo o, para confeccionar algún tipo de derivación biliar interna o externa paliativa que alivie la ictericia y el prurito.
En enfermos de alto riesgo o con mucho tiempo de evolución de la ictericia, podrá instalarse un drenaje externo con catéter por punción transparietohepática. Ello mejorará la función hepática y permitirá operar al paciente en condiciones más adecuadas. De lo contrario, será un eficaz paliativo, en especial si se logra que el cateter multifenestrado atraviese el sitio de la estenosis y se ubique en la vía biliar distal.
También se puede intentar como tratamiento paliativo, colocar un cateter multifenestrado o una cestilla expansible como endoprotesis (stent) a través de la estenosis, por vía endoscópica transduodenal, transpapilar.
Los índices de resecabilidad son bajos en las neoplasias de la vía biliar, generalmente no superan el 50 % de los casos.
Se consideran criterios de irresecabilidad la presencia de metástasis hepáticas y/o peritoneales, no asi al compromiso ganglionar vecino. Localmente, la invasión de la vena porta es la causa más frecuente de irresecabilidad de estos tumores.
Al extirpar una neoplasia del confluente quedan expuestos los dos hepáticos, a los cuales se lleva, para anastomosar, un asa intestinal desfuncionalizada (bihepaticoyeyunoanastomosis).
Las hepatectomías con resección del tumor, requieren una cuidadosa selección del paciente para obtener resultados acordes a la magnitud de la intervención.
Los trasplantes de hígado no han satisfecho las expectativas creadas y, salvo excepciones, los pacientes fallecieron antes del año por recidiva de la enfermedad.
Cuando el cáncer se localiza en el tercio medio, la resección segmentaría de la vía biliar, con duodenopancreatectomía o no, es el procedimiento de elección. Para los del tercio inferior, la resección duodenopancreática es la que ofrece mejores resultados.
En resumen, los procedimientos paliativos quirúrgicos pueden ser de dos tipos:
Derivaciones internas. En los tumores del tercio superior, con invasión de la placa hiliar, las anastomosis de conductos biliares al intestino después de resecciones parciales del parénquima hepático, (anastomosis biliodigestivas periféricas) dan corto tiempo de sobrevida.
En las localizaciones del tercio medio e inferior, la hepaticoyeyunostomía es el procedimiento de elección.
Derivaciones externas. Son la última opción que elige el cirujano en los tumores altos de la vía biliar. Existen diversas variantes: después de dilatar la estenosis neoplásica, instalar un tubo de Kehr o un cateter transhepático que deriva la bilis al exterior y al colédoco distal.
CANCER DE PAPILA
Los tumores de la región papilar, también llamados tumores vaterianos, periampulares o ampulomas, Se los halla en alrededor del 1% de las operaciones sobre las vías biliares y representan la tercera causa de obstrucción maligna de la vía biliar, después del cáncer de la cabeza del páncreas y de los tumores del hepatocolédoco.
Se presentan con mayor frecuencia entre la quinta y la séptima década de la vida y se distribuyen por igual en ambos sexos.
Su particular ubicación, por la cual generan síntomas en etapas tempranas de la evolución, su crecimiento lento y su relativamente discreto poder de diseminación hacen que un tratamiento quirúrgico adecuado y oportuno proporcione el mayor indice de curaciones entre las neoplasias malignas de la vía biliar y el páncreas.
Etiopatogenia
Se desconoce su etiología y no se han hallado factores ambientales que favorezcan su desarrollo.
La frecuencia del hallazgo de lesiones polipoideas en autopsias y en biopsias operatorias de la papila ha hecho pensar en una posible transformación maligna de estos procesos. Se han comunicado la observaciones de áreas malignizadas en papilomas ampulares. (Especialmente pólipos, con histología de adenoma velloso)
La litiasis no ha demostrado tener relación etiopatogénica con el cáncer de papila.
Anatomía patológica. Las neoplasias del área ampular pueden nacer en las mucosas que recubren la papila, la ampolla, el colédoco o el Wirsung terminal, o en el tejido pancreático vecino. Ello resulta muchas veces difícil de definir dada la semejanza de las células en razón de su origen embriológico común y el compromiso de varias de esas estructuras como consecuencia del crecimiento invasivo del tumor.
Conocer el origen puede tener valor pronóstico, ya que los resultados terapéuticos en las neoplasias nacidas en el Wirsung terminal o en el páncreas vecino deberán vincularse más al del cáncer pancreático que al de la papila.
Desde el punto de vista microscópico estos tumores presentan diversos grados de malignidad celular. Existen formas diferenciadas difíciles de distinguir de los adenomas, y otras indiferenciadas con gran anaplasia celular e infiltración.
El cáncer ampular es de crecimiento lento y de escaso poder de diseminación.
En etapas más avanzadas de su evolución pueden infiltrar la pared duodenal, el colédoco terminal y la cabeza del páncreas. Es excepcional, en cambio, que lleguen a comprometer la vena porta y las arterias hepática o mesentérica.
Estos tumores tienen una afinidad casi exclusiva por la diseminación linfática.
Muy poco frecuentes son, en cambio, las metástasis hepáticas, pulmonares y óseas.
Fisiopatología. Las neoplasias de la región ampular originan fundamentalmente una hipertensión biliar por obstrucción del colédoco terminal. Es poco frecuente observar la ictericia intermitente, en general es progresiva. En cambio, si es posible detectar oscilación en los valores de la bilirrubinemia, hecho que, como la ictericia intermitente, fue interpretado como producto de la necrosis tumoral, pero podrían ser debidos a episodios de colangitis facilitados por la obstrucción lenta y progresiva del poro papilar.
Las neoplasias que se ulceran pueden sangrar en la luz duodenal y condicionar una anemia que generalmente es crónica. Pérdidas más importantes de sangre serán las responsables de melena.
La obstrucción de la papila genera una dilatación significativa de la vía biliar intrahepática y extrahepática. El conducto pancreático también es afectado, aunque menos frecuentemente.
Cuadro clínico.
El cáncer de papila se pone en evidencia por un síndrome de hipertensión biliar (ictericia, acolia, coluria), en el cual algunos signos pueden orientar el diagnóstico. La anemia, la vesícula palpable, la existenciá de sangre oculta en materias fecales y la colangitis deben hacer sospechar la presencia de una neoplasia ampular.
El prurito es un síntoma frecuente, y se observan pérdida de peso, deterioro del estado general y dolor.
En resumen, el paciente con cáncer de papila puede presentar la ictericia «muda» que simula una neoplasia de páncreas o la hipertensión biliar intermitente y febril que caracteriza a la litiasis coledociana.
Métodos complementarios de diagnóstico
La ecografía o la tomografia computada permitirán llegar al diagnóstico de ictericia obstructiva al poner de manifiesto la dilatación del árbol biliar intrahepático, la distensión de la vesícula y el colédoco ubicarán la obstrucción en su porción distal.
La duodenografía hipotónica podrá mostrar las alteraciones que el tumor produce en la pared interna de la segunda porción duodenal.
El estudio contrastado de la vía biliar, por medio de la colangiografía trasparietohepática con aguja fina, permite ver con claridad la obstrucción en el extremo inferior del colédoco.
De mayor utilidad es la fibroduodenoscopía, que permite visualizar la papila y obtener una biopsia de ésta.
Una imagen endoscópica normal con mucosa papilar sana no excluye un carcinoma ampular, ya que éste puede corresponder a una variedad de nódulo intraampular, caso en el cual puede intentarse una toma de material endopapilar para su estudio anatomopatológico.
Diagnóstico diferencial
Deberá hacerse con las otras causas de obstrucción baja de las vía biliares: litiasis enclavada, neoplasia del páncreas, odditis o el adenoma de papila.
Es necesario el estudio anatomopatológico de cualquier lesión tumoral de la papila para evitar el error de realizar una gran resección duodenopancreática por un proceso benigno.
La muerte del paciente con cáncer de papila librado a su evolución natural se debe a la insuficiencia hepática con sus consecuencias metabólicas y a la infección biliar, no a la diseminación de la enfermedad.
Tratamiento
Procedimientos paliativos
Drenaje biliar externo con un catéter instalado por punción trasparietohepática
Intubación trastumoral por fibroduodenoscopía
Instalación de endoprótesis por fibroduodenoscopía
Las derivaciones biliodigestivas: En estos casos la hepaticoyeyunoanastomosis
con asa desfuncionalizada constituye la más seguras y de resultados más duraderos.
En los tumores ampulares está discutida la posibilidad de agregar a la derivación biliodigestiva una gastroenteroanastomosis, pues estas neoplasias excepcionalmente comprometen la luz duodenal.
Procedimientos resectivos.
La ampulectomía es un método de dudosa radicalidad.
La duodenopancreatectomia cefálica es el procedimiento radical de indicación más precisa siempre que el estado general del paciente lo permita.
Contraindicada en presencia de metástasis ganglionares o viscerales alejadas.
A diferencia de lo que sucede en las neoplasias de la cabeza del páncreas, la posibilidad de resección en los tumores ampulares es alta. Varía entre el 55 y el 90 % de los casos.
La duodenopancreatectomía está gravada por un considerable número de complicaciones posoperatorias, de las cuales las más frecuentes son el resultado de la anastomosis pancreatoyeyunal (fístulas pancreáticas, pancreatitis del páncreas residual), dehiscencia de la anastomosis hepaticoyeyunal o de la gastroyeyunal. La mortalidad postoperatoria oscila entre el 5 y el 20 %, aunque en los últimos años, con los mayores recursos terapéuticos y la mayor experiencia, estas cifras se han reducido.
Las sobrevidas a los 5 años en algunas series alcanzan al 59 %.
BIBLIOGRAFIA
-Boretti J., Lovesio C. Cirugía Tomo III Libreria El Ateneo Editorial. 1989
-Giffoniello A. Temas de Patología Quirúrgica Vol. 6 Universidad Nacional de Córdoba. Facultad de Medicina 1992
-Schwartz S., Shires G., Spencer F. Principios de Cirugía 5ª edición Tomo II
Nueva Editorial Interamericana Mc Graw Hill Inc. Mexico 1991
-Veronesi U. Cirugía Oncológica Editorial Médica Panamericana S.A. Bs. As. 1992
ASCITIS
Ascitis. Mecanismos de producción. Diagnóstico y Tratamiento
Las afecciones crónicas del hígado son las causas más comunes de la ascitis e implican la presencia de hipertensión portal.
DIAGNOSTICO
La principal manifestación de la ascitis es la distensión abdominal, la mayoría de las veces de aparición insidiosa: el paciente nota un cambio del tamaño de su cintura y la necesidad de modificar o cambiar la ropa.
El dolor no es un signo característico, aunque algunas veces existe una molestia dorsal imprecisa. La disnea aparece cuando la ascitis está a tensión. Muchas veces el examen físico muestra un paciente ictérico con evidencias de deterioro muscular.
El abdomen está distendido y se observan venas abdominales prominentes con circulación colateral de tipo portal, que se irradian desde el ombligo en dirrección cefálica y/o caudal. La matidez desplazable de los flancos es el signo más temprano de
ascitis. El hígado y el bazo son de difícil palpación cuando existe ascitis abundante, pero pueden provocar el signo del témpano.
Se puede encontrar onda ascítica.
El aumento de la tensión abdominal, puede producir la protrusión de las hernias, la mayoría de las cuales son umbilicales aunque también se observan las inguinales y a través de anteriores laparotomías.
Las radiografías simples de abdomen pueden mostrar hepatoesplenomegalia, opacidad difusa del abdomen con eliminación de la sombra de los psoas y separación de las asas intestinales. La radiografía de tórax puede revelar derrames pleurales.
La ecografía es de utilidad para el estudio de la ascitis, ya que puede detectar la presencia de cantidades pequeñas de líquido, aún 100 ml.
La presencia de ascitis se confirma con la paracentesis diagnóstica
En la cirrosis el líquido es un trasudado con una densidad inferior a 1.016 y una concentración de proteínas inferior a 2,5 gm/100 ml. El recuento celular es inferior a 300/ mm3, en su mayor parte constituido por células mononucleares.
DIAGNOSTICO DIFERENCIAL
La ascitis aparece en otros dos tipos de hipertensión portal: la obstrucción de las venas suprahepáticas (síndrome de Budd Chiari) y la trombosis de la vena porta.
En la obstrucción de las venas suprahepáticas el comienzo de la ascitis suele ser brusco. La ictericia es leve o está ausente y el hígado está muy agrandado, doloroso, de consistencia aumentada y de superficie lisa.
La ascitis es rara en presencia de trombosis portal no complicada pero puede aparecer luego de tratamientos infructuosos para su corrección quirúrgica.
La ascitis se desarrolla en algunos casos como complicación de las anastomosis portosistémicas. Por lo general, en estos casos se debe a insuficiencia hepatocelular o a la excesiva administración posoperatoria de soluciones salinas.
La ascitis muestra una particular predilección para aparecer en presencia de flujo portal invertido.
Por último, la ascitis en el posoperatorio puede deberse en algunos casos, a la trombosis de la anastomosis venosa.
Fuera de la hipertensión portal existen otras causas de ascitis
1. Ascitis relacionadas con neoplasias peritoneales. El líquido ascítico puede ser muy hemorrágico o contener hematíes; la concentración de proteínas es mayor que 2,5 gm/ l00 ml.
2. Ascitis relacionada con la tuberculosis. El líquido es turbio. Hay aumento del número de células, en especial de linfocitos. El diagnóstico se establece por el cultivo de los bacilos ácidorresistentes o por el estudio histológico de los granulomas.
3. Ascitis pancreática. Suele encontrarse asociada con seudoquistes de páncreas. El líquido tiene elevada concentración de proteínas y amilasas.
4. Ascitis quilosa debida al bloqueo linfático, en general por un linfoma.
Puede constituir también una complicación de un trauma quirúrgico inferido a la cisterna quilosa.
El líquido ascítico es de aspecto lechoso por su elevado contenido en lípidos, que puede demostrarse por la coloración con Sudán III.
5. Ascitis relacionada con la nefrosis, se acompaña con edemas generalizados y albuminuria.
6. Ascitis relacionada con la pericaditis constrictiva. El diagnóstico se reafirma por la presencia de calcificaciones pericárdicas, ingurgitación yugular y pulso paradojal.
PATOGENIA
Los factores que facilitan el desarrollo de la ascitis en la cirrosis son una combinación de hipertensión portal, reducción de la presión coloidosmótica intravascular por la hipoalbuminemia y aumento de la filtración de linfa a nivel de los linfáticos hepáticos distendidos.
El cambio principal que se observa en el sistema neurohormonal, es el aumento de la actividad simpática y el hiperaldosteronismo. El aumento de la actividad simpática debido a la estimulación de los barorreceptores, como consecuencia de la reducción del volumen intravascular.
Aumento de la retención de sodio. El aumento de la aldosterona se debe a la estimulación de la corteza adrenal por angiotensina.
En el paciente con cirrosis, se liberan grandes cantidades de renina como respuesta del aparato yuxtaglomerular a la redistribución del flujo sanguíneo y a la reducción de la irrigación de la corteza renal.
Existe además una alteración del clearence de agua, secundaria al aumento de la hormona antidiurética.
COMPLICACIONES DE LA ASCITIS
Los pacientes con cirrosis y ascitis están expuestos a desarrollar dos complicaciones importantes: la peritonitis bacteriana y el síndrome hepatorrenal.
La peritonitis bacteriana y la bacteriemia aparecen en forma espontánea sin
una aparente fuente clara de infección. Los síntomas principales son fiebre, dolor abdominal y disminución de los ruidos intestinales. El examen del líquido ascítico revela una elevada densidad, gran concentración de proteinas, y un recuento elevado de células. Leucocitos (> 300/ml). El hallazgo de más de 500 polimorfonucleares por ml es evidencia de peritonitis bacteriana aun en pacientes asintomáticos. Las bacterias que con mayor frecuencia se cultivan son la Escherichia colí,neumococos y estreptococos beta-hemolíticos. Las bacterias anaerobias sólo rara vez producen peritonitis.
El síndrome hepatorrenal se caracteriza por su aparición lenta, con oliguria y azoemia asociada con el deterioro de la función hepática. La diuresis diaria puede disminuir hasta llegar a sólo l00 o 150 ml, pero nunca llega a la anuria total. Son factores precipitantes reconocidos la depleción aguda del volumen plasmático secundaria a la administración de diuréticos, la paracentesis, las hemorragias digestivas o la septicemia. La causa de la insuficiencia renal parece estar vinculada con la redistribución del flujo renal excluyendo a los glomérulos.
El síndrome hepatorrenal debe ser diferenciado del daño tubular agudo, que puede ser producido por hipotensión, hipokalemia o exceso de administración de neomicina. En el daño tubular agudo el sedimento urinario muestra cilindros celulares
y anormalidades en la capacidad de concentración y retención de sodio.
No existe tratamiento específico para el síndrome hepatorrenal. Se trata, como otras situaciones de insuficiencia renal, mediante la restricción de los líquidos, sodio, potasio y proteínas. En algunos casos, la infusión de dopamina o la colocación de las derivaciones peritoneovenosas han producido mejorías de la función renal.
TRATAMIENTO MEDICO
Como consecuencia de la incapacidad que muestra el paciente cirrótico para excretar el sodio en forma efectiva, la mayor parte del sodio contenido en la dieta es retenido.
El tratamiento principal de la ascitis se basa en la restricción del sodio.
La natremia baja indica la retención de líquidos por encima del sodio retenido.
Los pacientes cirróticos tratados con reposo en cama y restricción de agua y sodio suelen desarrollar una diuresis espontánea que coincide con la mejoría de su función hepática.
El uso de diuréticos, con control de los electrolitos séricos, urea y creatinina se inicia con Espironolactona, que actua inhibiendo la acción de aldosterona, produciendo un aumento de la excreción de sodio y también reduce la pérdida de potasio. La dosis inicial es de 100 mg / día, que puede ser incrementada en forma gradual hasta 400 mg/día. La ginecomastia puede complicar la administración prolongada de espironolactona.
Para obtener una diuresis más efectiva se combina con hidroclorotiazida, 50 a 100 mg/día, o fursemida en dosis de 40 mg /día, pero puede producir una pérdida exagerada de potasio, por lo que se lo administra a este elemento en tabletas.
Las paracentesis diaria de 4 a 6 litros, junto con la infusión intravenosa de 40 g de albúmina pobre en sodio, ha sido efectiva para su control.
PRONOSTICO Y RESULTADOS DEL TRATAMIENTO MEDICO
El pronóstico de los pacientes con afecciones hepáticas que presentan ascitis es malo; se estima una supervivencia media de 2 años cercana al 40%. Este pronóstico depende, en forma especial, del estado funcional del hígado.
Es obvio que cuanto más avanzada es la afección hepática, con ictericia y encefalopatía, peor es el pronóstico.
La respuesta satisfactoria a los diuréticos, que determina el control de la ascitis pero no en forma necesaria su eliminación, se observa en el 75 % de los pacientes.
TRATAMIENTO QUIRURGICO
Cerca del 5% de los pacientes no muestran ninguna mejoría con el tratamiento médico y otro 20% sólo presentan una respuesta parcial. Para este grupo de pacientes se han ideado diversos tratamientos quirúrgicos. Ninguno de ellos tiene en la actualidad aplicación alguna en el tratamiento de la ascitis.
La única operación que en la actualidad se utiliza para el tratamiento de la ascitis refractaria al tratamiento, es la derivación peritoneo-venosa. Las derivaciones porto-sistémicas, no indicadas sólo para el tratamiento de la ascitis, han determinado
consecuencias sobre la ascitis que merecen especial consideración.
La ascitis es muchas veces un signo de enfermedad hepática avanzada y en algunos casos el trasplante hepático está indicado para revertir la insuficiencia hepática y aliviar la ascitis.
Efecto de las derivaciones portosistémicas
La presión sinusoidal aumentada, secundaria al bloqueo post sinuosidal, es uno de los factores involucrados en la producción de la ascitis.
Esta hipertensión sinusoidal causa, en forma presumible, aumento de la linfa hepática en los espacios de Disse y la formación de ascitis. El hiperaldosteronismo secundario está también relacionado de alguna forma con ese fenómeno. La mayoría de las derivaciones portosistémicas reducen la presión sinusoidal y, por ello, tienden a aliviar la ascitis, aunque algunas son más efectivas que otras en relación con ese
efecto.
La anastomosis portocava término-lateral elimina el aporte portal al flujo hepático y de esta forma reduce la presión intrahepática. Sin embargo, esos shunts no reducen la hipertensión sinusoidal a niveles normales. Por otra parte, tampoco mejoran la salida de la sangre hepática. Por ello, en los pacientes con estancamiento bidireccional, o con flujo portal invertido espontáneamente, esas anastomosis pueden condicionar aumento de la presión sinusoidal al eliminar la posibilidad del flujo retrógrado a través de la vena porta. Por esta razón es probable que entre el l0 y el 15% de los pacientes desarrollen ascitis luego de la creación de un shunt portocava término-lateral.
La anastomosis portocava látero-lateral no sólo deriva del hígado la sangre esplácnica sino que también sirve como tracto de salida para el flujo retrógrado de la sangre portal desde el hígado hacia la vena cava de menor presión. Es probable que, por esta razón, la presión sinusoidal se reduzca hasta lo normal luego de esas derivaciones. Por lo tanto, la anastomosis portocava látero-lateral ha mostrado ser efectiva para el tratamiento de la ascitis refractaria al tratamiento, controlando tanto el hiperaldosteronismo como el exceso de producción de linfa hepática.
Existen diversas técnicas para las derivaciones portosistémicas que en realidad funcionan como shunts látero-laterales. Entre ellas se incluyen el shunt esplenorrenal común, el mesocava directo, el mesocava con injerto en H, el portorrenal y otros, cuyos efectos fisiológicos son similares a los producidos por las anastomosis látero-laterales y hacen pensar que pueden ofrecer la misma efectividad.
Debe hacerse notar que los shunts portosistémicos electivos, como el esplenorrenal, han sido diseñados para preservar el flujo mesentérico-portal y por lo tanto, mantener una presión sinusoidal elevada y por ello tienden a producir o agravar la ascitis.
Estas operaciones no deben ser utilizadas sólo para el tratamiento de la ascitis. Sin embargo, cuando se precisa un shunt para controlar las várices esofágicas sangrantes, la selección específica del tipo de derivación que debe practicarse, por lo menos en parte, debe considerar la presencia o ausencia de ascitis grave o intratable.
PARACENTESIS
Esta terapéutica sigue siendo practicada; ya no se considera apropiado drenar la ascitis en forma completa, En la actualidad, el paciente se coloca en posición supina. Es importante que la vejiga esté vacía. Los lugares de preferencia para la inserción del catéter o el trócar se encuentran en la línea media, a un tercio de la distancia umbilicopubiana o inmediatamente por fuera del músculo recto anterior y en cualquiera de los cuadrantes inferiores. Se desinfecta y aisla la zona seleccionada y luego se efectúa anestesia local con lidocaina. Para la paracentesis se pueden utilizar diferentes técnicas pero quizás la más simple sea la de agregar tres orificios laterales en la porción terminal de un catéter común. Luego de punzar la cavidad abdominal con un trócar se introduce el catéter, se extrae el trócar y luego se aspira con una jeringa de tres vías. El catéter puede ser fijado a una tubuladura para infusiones intravenosas que se conecta a un recipiente colector colocado en el suelo, dejando que el líquido ascítico fluya por efecto de la gravedad.
DERIVACION PERITONEOVENOSA
La válvula activada por presión, diseñada por Leveen, se abre sólo cuando existe un gradiente de 3 a 5 cm de H2O entre la presión peritoneal y la de la vena cava superior intratorácica. De esta forma, si la presión venosa sube por la infusión excesiva de líquido ascítico, la válvula se cierra y evita el retroceso de la sangre hacia el tubo y su trombosis.
Los drenajes peritoneovenosos pueden insertarse bajo anestesia local, aunque se prefiere la general, cuando es posible, debido a la dificultad existente para la creación del túnel subcutáneo bajo los efectos de la primera.
En el preoperatorio se debe obtener una muestra de líquido ascítico para su cultivo y recuento celular. La colocación de la derivación peritoneo-cava está contra-indicada si el cultivo es positivo o si el recuento revela más de 300 elementos por ml.
Se efectúa una incisión abdominal transversal de 4 a 5 cm por fuera del músculo recto anterior y por debajo del reborde hepático; se divulsionan los músculos abdominales hasta alcanzar el peritoneo. Se colocan sobre el peritoneo jaretas opuestas de tracción, de material absorbible 3-0, para luego efectuar la apertura peritoneal entre ellas. Se
considera como un hecho bien establecido que el riesgo de la coagulación intravascular diseminada posoperatoria puede reducirse en forma significativa si se elimina la mayor parte del líquido ascítico en el momento de la operación.
Una vez que se ha evacuado el volumen deseado, se extrae la cánula de aspiración y se introduce en el peritoneo el tubo perforado y el tallo de la válvula.
Se tracciona de ambas jaretas ajustando los hilos alrededor del tallo de la válvula y dejando que el tubo perforado se llene con líquido ascítico, luego de haber eliminado su contenido aéreo, para luego pinzarlo con una pinza de Kelly con ramas acolchadas con tubos de goma. El extremo venoso del tubo se arrolla y se fija con una hebra larga de seda para facilitar su tracción y pasaje a través del túnel subcutáneo. En la zona supraclavicular homolateral se traza una incisión vertical o transversal, por detrás del borde posterior del estemocleidomastoideo.
Se lleva este músculo hacia adentro y se reconoce la vena yugular interna para luego liberarla en una extensión de 3 o 4 cm y aislarla entre pinzas vasculares o asas de hilo. Se crea un túnel subcutáneo mediante un instrumento adecuado y luego se arrastra a su través el extremo venoso del tubo hasta alcanzar el cuello. Se mide el tubo con cuidado, de modo que pueda ingresar a la vena yugular y alcanzar sólo hasta el segundo espacio intercostal. Para evitar la trombosis temprana del sistema, es imperativo que el tubo venoso sea colocado en este nivel, es decir a la altura de la unión de la vena cava superior con la aurícula derecha. Se recorta el exceso del tubo en pico de flauta descartando el sobrante. La válvula misma queda por fuera del peritoneo y recubierta por los músculos, aponeurosis, tejido subcutáneo y piel, que se cierran todos con sutura continua, incluyendo la piel, a fin de evitar la filtración del líquido ascítico.
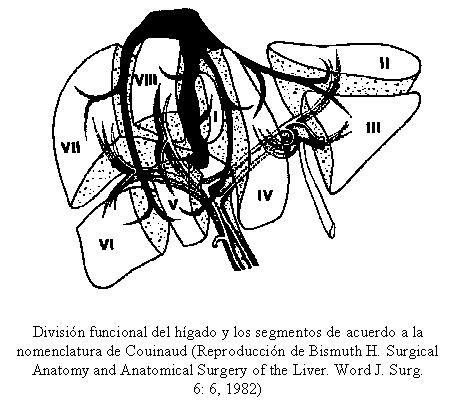
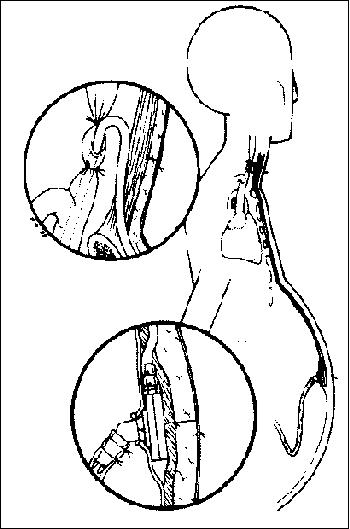 Diagrama que muestra la colocación de la derivación peritoneovenosa. La válvula se encuentra sobre el peritoneo y por debajo de los músculos abdominales. El tubo que se va a introducir en la vena se tuneliza en forma subcutánea a lo largo de la pared torácica hasta el cuello, donde ingresa en la vena yugular, (Tomado de Leveen H. H., Wapnick S., Grosberg S. and Kinney M. J.: Further experience with peritoneo-venous shunt for ascites. Ann. Surg., 184:574. 1976.)
Diagrama que muestra la colocación de la derivación peritoneovenosa. La válvula se encuentra sobre el peritoneo y por debajo de los músculos abdominales. El tubo que se va a introducir en la vena se tuneliza en forma subcutánea a lo largo de la pared torácica hasta el cuello, donde ingresa en la vena yugular, (Tomado de Leveen H. H., Wapnick S., Grosberg S. and Kinney M. J.: Further experience with peritoneo-venous shunt for ascites. Ann. Surg., 184:574. 1976.)
HIPERTENSIÓN PORTAL
La hipertensión en el sistema venoso portal puede ser inducida por varios procesos patológicos, la mayoría de los cuales probablemente hacen que se eleven las resistencias al flujo sanguíneo a través del hígado. El lugar donde ocurre este aumento de las resistencias ha proporcionado las bases para los esfuerzos encaminados a clasificar los diferentes tipos de hipertensión portal.
La obstrucción al flujo de salida venoso se ha denominado hipertensión portal post-sinusoidal o suprahepática. La producida por la cirrosis y por algunas otras enfermedades del parénquima hepático, se conoce como hipertensión portal intra-hepática, sinusoidal o postsinusoidal. La obstrucción del flujo de entrada portal se ha llamado hipertensión portal extrahepática, infrahepática o presinusoidal.
El lugar de la obstrucción venosa puede residir en el hígado,siendo por lo tanto intrahepática y ser al mismo tiempo postsinusoidal, como ocurre en la enfermedad venooclusiva, o ser sinusoidal (o postsinusoidal) como en la cirrosis, o ser presinusoidal como en la esquistosomiasis y en la esclerosis hepatoportal (hipertensión portal idiopática).
El aumento de la resistencia vascular en cualquier lugar del circuito portal ocasiona dilatación, estasis e hipertensión del lecho venoso esplácnico por detrás del hígado. Esto a su vez estimula el desarrollo de colaterales venosas que circunvalan la obstrucción hepática.
Anatomía patológica
Los sistemas colaterales más importantes son el sistema coronario-ácigos, causante de las varices esofágicas y esofagogástricas; el sistema umbilical de la pared abdominal, que pueden producir el síndrome de Cruveilhier-Baumgarten (venas colaterales muy grandes y tortuosas que se asocian con murmullo); las venas de Retzius, que representan conexiones portocavales en la región posterior o retroperitoneal; las venas de Sappey, que son conexiones entre la cara posterosuperior del hígado, el diafragma y el pericardio; y por último el sistema hemorroidal superior, medio e inferior, causante de las hemorroides internas y externas.
Aunque el volumen de sangre que llevan estas colaterales es, a veces, muy elevado, nunca puede quedar del todo aliviada la hipertensión portal, debido a que el estímulo para el desarrollo de estas colaterales es la misma hipertensión portal.
En el aspecto clínico existe una cierta correlación directa entre el tamaño de las varices esofágicas y el nivel de la hipertensión portal.
Algunos autores han postulado que la causa primaria de la hipertensión portal, al menos en algunas enfermedades, es una elevación del flujo arterial esplácnico, ya sea directamente, ya sea a través de cortos circuitos arteriovenosos en el bazo o en la submucosa del estómago y del intestino delgado.
A consecuencia de esta hipertensión, o asociada con la misma, es entonces que se congestionan la vías colaterales ya mencionadas, produciendose como vimos várices esofagogástricas que pueden ser causa de hemorragia.
Todavía es motivo de discusión si las hemorragias dependen de aumentos bruscos de la presión portal o si se deben a traumatismos o esofagitis péptica, o lo más probable a la combinación de más de una de estas causas.
La hipertensión portal, a consecuencia fundamentalmente de la hiperpresión vascular a nivel del sinusoide hepático, condiciona la aparición de ascitis.
El aumento de la presión a nivel del eje venoso portal, incrementandose de este modo la presión en la vena esplénica, condiciona un estasis venoso y secuencialmnente una congestión pasiva esplénica, que puede llevar a un hiperesplenismo. (Entendiéndose como tal el aumento de todas las funciones del bazo, que a su vez produce anemia, leucopenia y plaquetopenia)
El deterioro progresivo de la función hepática, puede llevar a la hiperamonemia, encefalopatía y coma hepático.
Clasificación de la hipertensión portal
Obstrucción presinusoidal
Extrahepática
Trombosis de la vena porta
1. Atresia congénita
2. Onfalitis neonatal
3. Pileflebitis (secundaria a sepsis intraperitoneal)
4. Estados de hipercoagulabilidad (policitemia, trombocitosis, anticonceptivos orales)
5. Estasis (cirrosis, deshidratación grave)
6. Traumatismos
7. lnflamaciones vecinas (pancreatitis, enterocolitis)
8. Obstrucción mecánica (tumores, adenopatías periportales, pancreatitis)
Intrahepática
Esquistosomiasis
Fibrosis hepática congénita
Esclerosis hepatoportal (hipertensión portal primaria)
Trastornos mieloproliferativos (enfermedad de Hodgkin, leucemia mieloide)
Sarcoidosis y enfermedad de Gaucher
Toxicidad por arsénico
Cirrosis biliar primaria
Obstrucción sinusoidal
Degeneración grasa
Hepatitis tóxica
Enfermedad de Wilson
Cirrosis
Obstrucción post sinusoidal
Intrahepática
Cirrosis
1. Nutricional (alcohólica)
2. Postnecrótica
3. Biliar secundaria
Hemocromatosis
Hepatitis viral
Hepatitis alcohólica
Síndrome de Budd-Chiari (intrahepático)
1. Enfermedad venooclusiva
2. Estados de hipercoagulabilidad (hemoglobinuria paroxística nocturna, anticonceptivos orales)
Extrahepáticas
Síndrome de Budd-Chiari (extrahepático)
1. Tabiques congénitos suprahepáticos de la cava
2. Neoplasias hepáticas, renales y suprarrenales
3. Traumatismos
4. Sepsis
Causas cardíacas
1. Pericarditis constrictiva
2. Insuficiencia cardíaca congestiva
Hipertensión portal por hiperflujo
Fístula arteriovenosa
1. Entre arteria hepática y vena porta
2. Esplénica
3. Mesentérica
Esplenomegalia masiva
Clasificación tomada de Zuidema Shackelford Enfermedades del aparato Digestivo 3ª Edición Editorial Médica Panamericana
En las formas obstructivas de la hipertensión portal, puede haber aumento también del flujo portal.
En general la hipertensión portal presinusoidal, no se asocia con alteraciones hepatocelulares graves, situación que si se observa en la postsinusoidal. Por ello ni la trombosis de la vena porta (Presinusoidal extrahepática), ni la esquistosomiasis (Presinusoidal intrahepática) producen alteraciones de la función hepática.
Por otra parte, la cirrosis es una afección hepatocelular primaria que se asocia con los tres tipos de obstrucción; el síndrome de Budd-Chiari produce disfunción hepática como consecuencia de la congestión hepática.
En relación con estas diferencias, el pronóstico de los pacientes con obstrucción sinusoidal y post sinusoidal tiende a ser peor que en los bloqueos presinusoidales.
Valoración basada en la fisiopatología
La diferenciación entre bloqueos presinusoidales y post sinusoidales depende de la medición de dos variables fisiológicas; la presión venosa portal (PVP) y la presión suprahepática enclavada (PSE).
La PVP puede medirse de diferentes formas; 1) por la inserción directa de
una aguja o catéter en la vena porta o en una de sus ramas colaterales durante una laparotomía; 2) por la introducción percutánea de un catéter en la pulpa esplénica;
3) por la cateterización de la vena umbilical y 4) por la inserción transhepática percutánea de un catéter en el lecho portal.
Cuando existe hipertensión sinusoidal o post sinusoidal, la PVP y la PSE se en-
cuentran elevadas, mientras que en la obstrucción presinusoidal la PSE es normal y la
PVP es elevada.
Fisiopatología
La presión portal normal es menor de 250 mm de H2O, con un valor medio de 215 mm de H2O y puede evaluarse como hemos visto por diversas técnicas.
En todos los casos de hipertensión portal, aumenta la presión de la pulpa esplénica, la presión suele ser 2-6mm Hg más alta que la presión de la vena porta misma.
Métodos auxiliares de diagnóstico
La manometría de la pulpa esplénica se lleva a cabo bajo anestesia local, pero está contraindicada en pacientes con tendencia a la hemorragia, trombocitopenia o ictericia intensa.
La esplenoportografía o la fase venosa de la arteriografía del tonco celíaco o de la mesentérica superior, define las características patológicas de la circulación portal.
Los estudios ayudan a demostrar venas colaterales, sobre todo várices esofagogástricas; también permiten la demostración gráfica del sitio de la obstrucción, es decir intrahepático o extrahepático.
Por lo general con esta técnica se puede definir la vena coronaria estomáquica que contribuye principalmente a las várices esofágicas.
EVOLUCION NATURAL
La hipertensión portal carente de complicaciones es asintomática.
Cuando se trata de un bloqueo presinusoidal, como sucede en la trombosis de la vena porta, la única causa de complicación letal es la hemorragia por várices. Dado que estos pacientes presentan una función hepática normal, el riesgo de muerte de cada episodio de hemorragia es del 5 al 10%, aun cuando exista hiperesplenismo.
El peligro de la hemorragia recurrente es grande.
En el bloqueo post sinusoidal determinado por afecciones de las venas suprahepáticas, el daño hepatocelular es secundario y depende de la congestión. En la fase aguda, estos pacientes pueden morir de insuficiencia hepática y, raras veces, por hemorragias varicosas. Si el paciente sobrevive a la fase aguda, se produce la regeneración y la fibrosis del hígado originando una cirrosis, con hipertensión portal y, por cierto, el riesgo de sangrado de las várices esofágicas.
El pronóstico para los pacientes con hipertensión portal secundaria a la cirrosis hepática depende, en forma principal, de la enfermedad de base. Entre los pacientes cirróticos con várices esofágicas demostradas, el 34% muere por hemorragias, el 32% fallece por insuficiencia hepática, el 11% muere por insuficiencia renal, el 9% por infecciones y el 14% por otras causas diversas.
Es importante saber que sólo el 50% de los pacientes cirróticos desarrollan várices esofágicas y sólo el 20% (la mitad de los que tienen várices) sangran a través de ellas.
También es interesante considerar que la hemorragia se produce dentro de los dos primeros años siguientes al diagnóstico de las várices en el 90% de los pacientes
que presentan esa complicación.
La muerte acompaña el episodio inicial entre el 30 y el 80% de los casos.
La supervivencia a 5 años, de los pacientes que han sangrado por várices, varía entre el 0 y el 35 %.
ESTUDIOS DIAGNOSTICOS
No existe una historia clínica que sea específica para el diagnóstico de hipertensión portal.
El único signo indicativo de esta condición es la presencia de la cabeza
de medusa. Los vasos colaterales de la pared abdominal, cuando están dilatados, forman la cabeza de medusa que se irradia desde el ombligo y manifiesta una dirección centrífuga de su circulación sanguínea.
Otros signos físicos sugieren la hipertensión portal pero no son diagnósticos, como la esplenomegalia, la ascitis, el estado de confusión y el temblor de la encefalopatía y las hemorroides.
La presencia de la hipertensión portal se anuncia, con frecuencia, por el desarrollo de hemorragia varicosa o de ascitis.
La enfermedad de las venas suprahepáticas, de tipo post sinusoidal, puede suceder también en ausencia de una afección hepatocelular, pero la ascitis masiva y el desarrollo de daño hepático debido a la congestión puede hacer más evidente el diagnóstico.
La cirrosis es la causa más frecuente de hipertensión portal. En consecuencia, los antecedentes de alcoholismo, hepatitis, exposición a hepatotóxicos o ictericía, así como los signos de palmas hepáticas, retracciones de Dupuytren, angiomas arácnidos, hipertrofia parotídea, ginecomastia, atrofia testicular, hepatoesplenomegalia, ascitis y temblores sirven para indicar que el paciente padece alguna afección hepática y que la hipertensión portal debe ser considerada.
Los métodos disponibles para la medición de la presión portal ya han sido citados al describir las diferencias entre bloqueos presinusoidales y post sinusoidales.
La causa más común es la cirrosis del hígado. En consecuencia, la función hepática debe ser bien estudiada. Las pruebas habituales de la funcionalidad hepática: seroalbúmina, bilirrubina sérica, tiempo de protrombina y las que sugieren la necrosis hepática activa (aspartato-aminotransferasa [AST], alanino-aminotransferasa [ALT] y lactato-dehidrogenasa [LDH]). En la obstrucción presinusoidal esas pruebas tienden a expresar resultados normales, mientras que en el síndrome de Budd-Chiari suele haber una concentración elevada de fosfatasa alcalina, cierta elevación de la bilirrubina y ligeras anormalidades de las otras pruebas funcionales hepáticas, asociadas con una
ascitis masiva y hepatomegalia.
Se debe considerar la posibilidad de efectuar una biopsia hepática toda vez que exista una duda razonable.
Las complicaciones de la hipertensión portal son la ascitis, la encefalopatía, el hiperesplenismo y las várices esofágicas. La ascitis suele ser detectada durante el examen físico
La encefalopatía debe sospecharse en presencia de confusión y temblores. Este diagnóstico, que luego puede ser confirmado con la determinación de amonio en sangre y electroencefalograma.
Al hiperesplenismo se lo puede identificar por el recuento de plaquetas y otros estudios hematológicos.
La complicación establecida por la presencia de várices esofágicas, pueden determinar hemorragias espectaculares y constituyen la indicación más común para la intervención quirúrgica.
El estudio inicial de las várices esofágicas se realiza mediante radiología complementada con la ingesta de una lechada de bario, tiene una exactitud que llega sólo al 60% y puede ser aumentada si se utiliza la cinerradiografía, las maniobras de Valsalva.
La esofagoscopía realizada con un fibroscopio posee una exactitud entre el 70 y el 97%; puede documentar no sólo la presencia de las várices sino también la existencia de hemorragia originada en ellas.
Permite demostrar la presencia de otras causas frecuentes de hemorragia alta, como la esofagitis, los desgarros de Mallory-Weiss y la gastritis.
Además, existen cuatro técnicas angiográficas para el diagnóstico de las várices esofágicas: La más antigua de ellas es la esplenoportografía, que se realiza mediante la introducción de una aguja en la pulpa esplénica; este abordaje permite la determinación de la presión de la pulpa esplénica y la estimación de la presión portal libre.
Otro método directo de introducir material de contraste angiográfico en el sistema portal es la portografía umbilical.
La canalización de la vena umbilical permite no sólo la portografía, sino la medición de la presión portal así como la introducción de diversos agentes farmacoló-gicos en el lecho portal
El abordaje más reciente para el diagnóstico de las várices esofágicas es la portografía percutánea transhepática.
La fase venosa de la arteriografía, suele ser, en la actualidad, la técnica de uso más frecuente para demostrar las várices esofágicas y para estudiar la circulación venosa portal.
Existen otros estudios que, en algunas ocasiones, pueden ser de utilidad en el estudio de
la hipertensión portal. El venograma suprahepático enclavado hace posible observar detalles de la morfología sinusoidal.
La arteriografía también puede ser útil. El arteriograma hepático muestra típicos cambios en la cirrosis y puede demostrar la presencia de otra patología asociada, como el hepatoma. La arteriografía del tronco celíaco y de la mesentérica superior también puede identificar la fuente de una hemorragia digestiva alta, diferente de las várices
esofágicas.
Los estudios con radioisótopos. Los rastreos hepáticos con radioisótopos, en general realizados con sulfuro colodial de 99Tc muestran los cambios difusos típicos de la cirrosis y también pueden evidenciar defectos localizados.
Existe un interés creciente por la determinación del flujo sanguíneo hepático y para ello se han descrito diversos métodos, muchos de los cuales se utilizan con cana-
lizaciones de las venas suprahepáticas o con técnicas radioisotópicas.
La punción biopsia de hígado puede ser muy útil.
TRATAMIENTO DE URGENCIA MEDICO Y QUIRURGICO DE LAS VARICES ESOFAGICAS SANGRANTES
De las cuatro complicaciones importantes de la hipertensión portal, sólo la hemorragia por várices esofágicas puede convertirse en un problema de urgencia.
El tratamiento médico de la hipertensión portal, por sí mismo, es el de la
enfermedad de base, en general la cirrosis hepática.
El paciente con disrrupción varicosa se presenta con hemorragia digestiva alta y el primer paso consiste en realizar el diagnóstico específico.
La localización precisa de la hemorragia requiere la ejecución de alguno de los
procedimientos diagnósticos ya mencionados.
En situación de urgencia no son apropiados los estudios radiológicos con bario, primero por que esos estudios no pueden descubrir otras causas de hemorragia digestiva alta, como el síndrome de Mallory-Weiss o la gastritis, y segundo, porque la presencia de bario interfiere con la endoscopia y la arteriografía. El enfoque inicial debe ser la esofagogastroduodenoscopía. En todo caso, antes de realizar este estudio se debe evacuar el contenido de sangre y coágulos del estómago con lavados profusos con solución salina enfriada a través de un grueso tubo nasogástrico. Si la hemorragia masiva impide la endoscopia, el enfoque alternativo es la angiografía selectiva del tronco celíaco, de la arteria esplénica y mesentérica superior.
La angiografía puede demostrar la presencia de una arteria sangrante siempre que el escape de sangre supere los 6 ml/min.
Aunque la arteriografía puede fracasar en el intento de demostrar la pérdida de sangre por las várices puede, por cierto, mostrar esas alteraciones y eliminar otras posibles fuentes. Por otra parte, cuando existe una hemorragia exsanguinante, lo más apropiado será instituir las medidas de urgencia para el control de la hemorragia masiva dejando para más tarde la determinación de la etiología causal.
TRATAMIENTO MEDICO DE SOSTEN Y LAVADO
El paciente cirrótico con hemorragia por várices esofágicas sufre una enfermedad grave con múltiples manifestaciones tardías. Estos pacientes mueren, muchas veces, más por insuficiencia hepática, insuficiencia renal o infecciones que por la exsanguinación. De acuerdo con ello, el tratamiento médico de sostén es crítico para la supervivencia. La primera prioridad es el remplazo rápido del volumen sanguíneo,
al principio con cristaloides y luego, tan pronto sea posible, con sangre total. Se debe tener cuidado en evitar la administración de líquidos que contengan demasiada sal porque existe una ávida retención de sodio.
La sangre administrada debe ser lo más fresca posible a fin de reemplazar los factores de coagulación que se han perdido, evitar la formación de amonio, que se produce en la sangre almacenada. La restauración del volumen sanguíneo debe ser controlada mediante una sonda de Foley vesical y con el control de la presión venosa central, sea por un catéter en la vena cava o con uno de Swan-Ganz.
La prevención de la encefalopatía requiere la eliminación de la sangre del estómago y del colon con lavados y enemas, respectivamente. La evacuación intestinal se promueve con la instilación de citrato de magnesio a través de la sonda nasogástrica.
Se retarda la producción de amonio en el colon utilizando neomicina o lactulosa, ambas por la sonda nasogástrica y por enemas.
La insuficiencia hepática necesita el sostén aportado por la administración intravenosa de soluciones hipertónicas de glucosa que contengan vitaminas B y C, junto con la administración parenteral de vitamina K.
El tratamiento inicial de la hemorragia digestiva alta con soluciones o agua enfriada es
una práctica de aplicación casi universal.
TRATAMIENTO FARMACOLOGICO
La vasopresina es el fármaco que se utiliza con más frecuencia en el control de la hemorragia por várices esofágicas.
Se usa por vía intravenosa a razón de 20 unidades (en bolo) en 500 ml de solución glucosada, o por infusión continua.
Se utilizó también vasopresina a través de un catéter ubicado en la arteria mesentérica superior.
El cese inicial no es sinónimo de supervivencia y la hemorragia puede recidivar.
El uso de vasopresina no está exento de complicaciones: hipertensión, bradicardia, arritmias cardíacas, edema agudo de pulmón, infarto de miocardio y retención acuosa grave.
Vasopresina, proporciona un control transitorio de la hemorragia varicosa y
no produce mejorías en lo referente a la supervivencia prolongada. La velocidad inicial de infusión es de 0,4 unidades/min, que puede ser aumentada hasta 0,9 unidades/min.,
luego, la velocidad de la infusión se reduce.
Este procedimiento puede detener una hemorragia varicosa durante el tiempo suficiente para colocar el balón de Sengstaken-Blakemore.
Se han utilizado otras drogas junto con la vasopresina con el intento de controlar sus efectos colaterales: El nitroprusiato de sodio, la nitroglicerina, que se administra por vía intravenosa, sublingual o transdérmica.
La vasopresina también ha sido utilizada en forma intraoperatoria para reducir el sangrado de las várices durante la ejecución de las derivaciones portosistémicas.
En el momento actual se están usando otras drogas destinadas al control farmacológico de la hemorragia por várices esofágicas, la más promisoria es la somatostatina
La terapéutica farmacológica se ha utilizado también para la prevención alejada de esa complicación. El propranolol es la droga que se utiliza en forma profiláctica.
TAPONAMIENTO CON BALON
El taponamiento con balón ha llegado a ser el método más utilizado para el control transitorio de la hemorragia varicosa.
La colocación del balón de Sengstaken-Blakemore debe ser realizada en forma
minuciosa si se desea evitar graves complicaciones. El pasaje nasal y por la nasofaringe debe efectuarse luego de una prolija anestesia con agentes tópicos. Una vez que el tubo se encuentra alojado en el estómago se procede a lavar ese órgano con agua helada para eliminar la sangre y los coágulos. Se infla el balón gástrico con 50 ml de aire y se obtiene una radiografía que asegura su correcta posición en el estómago.
Una vez seguro de ello, se agregan 250 ml de aire al balón gástrico para, luego, cerrar en forma segura la vía que lo drena. Se tracciona del tubo hasta sentir que el balón apoya en la unión gastroesofágica y entonces se lo fija.
En estas condiciones el paciente queda impedido para deglutir por lo que se de-
be establecer una aspiración del esófago por encima del balón gástrico, esta maniobra reduce el riesgo de la neumonitis aspirativa.
Con en el tubo en su lugar y el balón gástrico inflado, la hemorragia debe interrumpirse tal como se puede establecer por el lavado gástrico y la aspiración esofágica. Si ello no ocurre, se puede inflar el balón hasta con 450 ml de aire.
Si a pesar de ello la hemorragia continúa, se infla el balón esofágico a una presión de 35 mm de Hg. La persistencia de la hemorragia indica que este tratamiento es infructuoso.
Una vez que la hemorragia se ha detenido se deja el balón en posición durante 24 horas. Al terminar ese lapso se desinfla el balón esofágico y a las 24 horas siguientes el gástrico.
El uso de los tubos de Nachlas o de Linton es similar con la excepción de que ambos tienen sólo un balón, el gástrico.
ESCLEROTERAPIA ENDOSCOPICA
La técnica de la escleroterapia endoscópica, descrita en 1939, es el enfoque no operatorio más apreciado para el tratamiento de las varices esofágicas. Su importancia ha alcanzado un nivel tan alto como para constituirse en el procedimiento inicial definitivo de elección, tanto para la urgencia como para el tratamiento electivo de las várices esofágicas sangrantes.
TRATAMIENTO QUIRURGICO
LIGADURA DE LAS VARICES
La ligadura de las várices es un procedimiento de urgencia para el control de las hemorragias agudas que fue introducido por Boerema y Crile, ha sido suplantada en la actualidad, por la escleroterapia endoscópica.
La incidencia de la hemorragia recurrente era del 28 al 83%, a menos que se efectuara luego una anastomosis portosistémica.
SECCION DEL ESOFAGO
La sección del esófago distal, propuesta primero por Walker, fue mejorado con el uso del «botón» mecánico de Boerema.
La innovación más reciente de la técnica de la sección esofágica es el uso de los aparatos de suturas mecánicas, el aparato EEA es el que se utiliza con mayor fre-
cuencia. La técnica para el uso de este último instrumento consiste en exponer el esófago a través de una incisión subcostal izquierda. Se expone la unión gastroesofágica separando el lóbulo izquierdo del hígado. Se movilizan los últimos 3 cm del esófago.
se realiza una gastrotomía vertical alta, a continuación se introduce el equipo EEA en
el esófago inferior utilizando el cartucho de mayor tamaño posible (en general, de 28 mm).
El cartucho y el yunque se separan para permitir que la zona por abrochar se encuentre en la parte liberada del esófago. Se ajusta con firmeza la hebra de Prolene que rodea el esófago contra el vástago central. Se ajusta también el equipo y luego de proceder a su disparo se lo extrae con cuidado utilizando un suave movimiento de rotación. Se deben controlar el cartucho y el yunque para asegurar que se ha extirpado una rosca que incluya todas las capas del esófago. La gastrotomía se cierra con una sutura en dos planos. El paso final de la operación es la identificación y ligadura en varios lugares de la vena coronaria.
DERIVACIONES PORTOSISTEMICAS
Existen numerosas técnicas de derivación portosistémica. La mayoría de ellas no son utilizadas en condiciones de urgencia. Sin embargo, sólo tres de ellas se han utilizado para controlar la hemorragia por várices esofágicas, en condiciones de urgencia: el shunt portocava término-lateral, el látero-lateral y el shunt mesocava con injerto en H.
La incidencia general de la encefalopatía entre estos pacientes con prolongada supervivencia llega al 18%. El shunt portocava de urgencia tiene una mortalidad operatoria general del 44% aproximadamente.
SELECCION DE LOS PACIENTES E INDICACIONES PARA, EL TRATAMIENTO
QUIRURGICO
En cualquier paciente cirrótico con hipertensión portal, la realización de una operación, en especial el shunt portocava, ha sido considerada desde hace mucho tiempo como portadora de un significativo riesgo de muerte. Esas operaciones también se asocian con la posibilidad alejada de morbilidad, como la encefalopatía e insuficiencia hepática progresiva.
De acuerdo con ello, se han establecido diferentes criterios para predecir los riesgos quirúrgicos y el desarrollo final de la encefalopatía y de la insuficiencia hepática, así como también la probable supervivencia prolongada.
Criterios clínicos de selección
Desde el principio se reconoció que el paciente con ictericia, ascitis y encefalopatía era un candidato para la operación de peor calidad que el paciente que no presentaba esas complicaciones. También ha resultado claro que en condiciones de urgencia, las operaciones presentan mayores riesgos que las electivas.
Child publicó su clasificación basada en el estudio de la función hepática y en los signos clínicos, que desde entonces ha logrado aceptación general. Esta clasificación define 3 grupos de pacientes en base a la alteración leve, moderada y grave de la función hepática.
A pesar de su continua popularidad, la clasificación de Child ha sido criticada por dos razones: 1) omite ciertas características de la cirrosis que se consideran importantes, y 2) la asignación de un paciente a un grupo determinado puede resultar algo arbitraria.
Se ha encontrado que la presencia de necrosis hepática activa, en especial en la hepatitis alcohólica aguda, y en menor extensión en la hepatitis crónica activa, aumenta la mortalidad quirúrgica. En consecuencia, la posibilidad de la existencia de una afección hepatocelular activa debe ser establecida en el preoperatorio con los estudios enzimáticos, en especial la AST, ALT y LDH. La hepatitis crónica activa puede ser reconocida con las preparaciones para células del lupus eritematoso (LE), anticuerpos antinucleares, anticuerpos contra las fibras musculares lisas y dosaje del nivel de complemento en suero. Este último puede estar disminuido y todos los otros elevados. Si todavía persisten dudas razonables, se deberá efectuar una punción biopsia hepática.
En el momento actual, parecería que los mejores criterios de selección clínica, son los descriptos por Child, con el agregado del dosaje de transaminasas.
Clasificación clínica y de laboratorio de los pacientes con cirrosis, en términos de reserva funcional hepática
| Clasificación | |||
| Criterios | Bueno A | Moderado B | Malo C |
| Bilirrubina Sérica (mg/100 ml)Seroalbúmina (g/100 mlAscitisEncefalopatía
Nutrición |
Menos de 2,0Más de 3,5NoNo
Excelente |
2,0 – 3,03,0 – 3,5De fácil controlMínima
Buena |
Más de 3,0Menos de 3,0Mal controladaAvanzada, «coma»
Mala, «emaciación» |
Adadptado de Child C.G. III and Turcone J.G.: Surgery and Portal Hypertension. En Child C.G. III The Liver and Portal Hypertension. Filadelfia. W.B. Saunders 1964 p. 50.
Estudios prospectivos controlados han demostrado que el shunt portocava profiláctico, indicado por la sola presencia de las várices esofágicas no es efectivo para prevenir la hemorragia de origen en dichas várices.
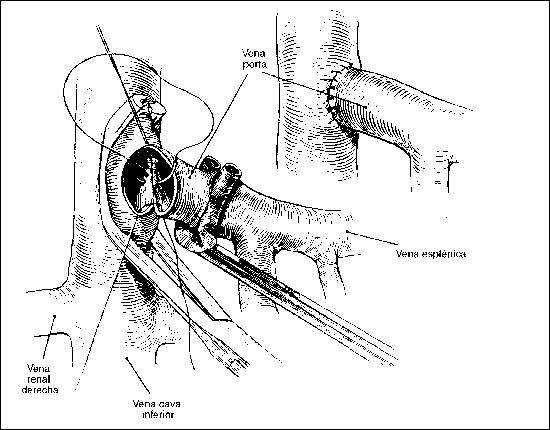
SHUNTS PORTOCAVAS
Shunt portocava término-lateral. Se han colocado puntos de tracción en los ángulos y se está confeccionando el plano posterior de la anastomosis. Se puede observar el uso del clamp de Blalock sobre la vena porta. El shunt terminado se muestra arriba y a la derecha. (Tomado de Zuidema G. D., Cameron J. L. and Zeppa R.: Portal hypertension, II: Operative procedures. En Nora P. F.: Operative Surgery: Principles and Techniques. Filadelfia, Lea & Febiger, 1980, p. 649.)
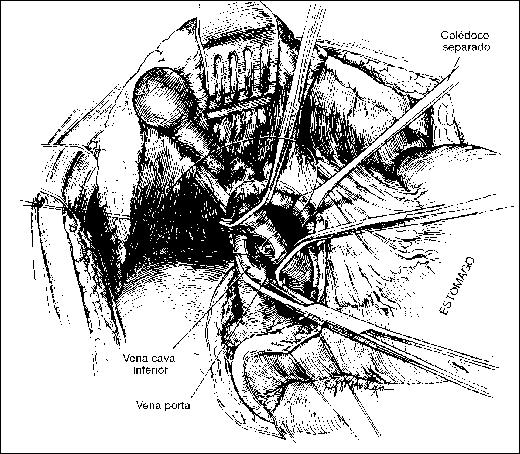
Técnica de la anastomosis portocava laterolateral modificada
Tomado de P. F. Nora. Cirugía General Principios y Tecnicas 2ª Ed. Salvat
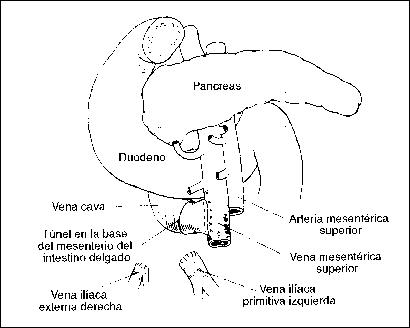 Shunt mesocava directo. Relaciones de la anastomosis terminada
Shunt mesocava directo. Relaciones de la anastomosis terminada
Con el duodeno y el páncreas. Zuidema Cirugía del aparato Digestivo
Primer punto de la sutura continua eversora para la anastomosis terminolateral entre la vena esplénica y la renal.
En la figura de la derecha se presenta la anastomosis completada Tomado de Nora P.F. 2ª Edición
 Representación esquemática de una anastomosis esplenorenal distal
Representación esquemática de una anastomosis esplenorenal distal
OPERACIONES SIN SHUNT
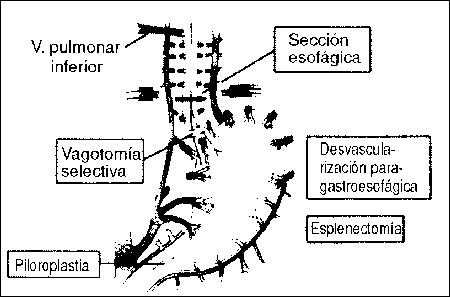
Operación de Sugiura Tomado de Sugiura and Futagawa
Arch Surg 112: 1317, 1977
QUISTES Y TUMORES DEL HÍGADO
Quistes no parasitarios
Estas lesiones pueden ser simples, múltiples, difusas, localizadas, uniloculares o multiloculares.
Entre ellas se incluyen:
- quistes sanguíneos y degenerativos
- quistes dermoides
- quistes linfáticos
- quistes endoteliales
- quistes de retención que pueden ser: de retención solitaria o de retención múltiple (enfermedad cística)
- quistes proliferativos (cistadenomas).
La enfermedad quística y los quistes solitarios no parasitarios que producen manifestaciones clínicas son más frecuentes en el cuarto, quinto y sexto decenios de la vida, a una edad promedio de 52 años.
La enfermedad hepática poliquística también es más común en la mujer.
ANATOMIA PATOLOGICA Los quistes solitarios no parasitarios suelen localizarse en el lóbulo hepático derecho. Tienen un contenido transparente y acuoso y es característico que la presión interna sea baja en comparación con la de los quistes parasitarios. En ocasiones, el líquido es de color pardo amarillento, lo cual indica necrosis del parénquima adyacente.
La enfermedad poliquística del hígado tiene un aspecto en panal de abeja con múltiples cavidades y las lesiones suelen distribuirse en todo el hígado, pero a veces un solo lóbulo es el afectado, con mayor frecuencia el derecho.
La enfermedad poliquística del hígado a menudo se asocia con quistes en otros órganos; ej., riñones poliquísticos (51,6 %). A la inversa, la frecuencia de quistes hepáticos en pacientes con enfermedad renal poliquística varía entre 19 y 34 %.
Se considera al hígado poliquístico como causa rara de hipertensión portal y también se le asocia con atrofia de las vías biliares, colangitis y hemangiomas.
Los quistes traumáticos suelen ser únicos, están llenos de bilis y no tienen un revestimiento epitelial.
Los cistoadenomas son lisos, encapsulados y lobulares y contienen material mucoide. Están revestidos por un epitelio columnar proliferativo.
MANIFESTACIONES CLINICAS. Tanto las lesiones solitarias como las poliquísticas crecen con lentitud y son relativamente asintomáticas.
Una masa indolora en el cuadrante superior derecho es la molestia más frecuente y cuando ocurren síntomas por lo general guardan relación con la presión ejercida sobre vísceras adyacentes.
El dolor abdominal agudo acompaña a las complicaciones de hemorragia intraquística o rotura intraperitoneal. La exploración física revela la masa y pueden palparse los riñones.
Las pruebas de funcionamiento hepático son de poca utilidad diagnóstica. Se han utilizado la gammagrafia, TAC, ultrasonografía y la arteriografia para definir la posición intrahepática de la masa; y la peritoneoscopia confirma el diagnóstico.
TRATAMIENTO. Con las excepciones de rotura, torsión y hemorragia intracistica, el tratamiento es electivo. Los quistes no parasitarios asintomáticos se tratan por medios quirúrgicos o mediante drenaje percutáneo. Si hay una indicación para la intervención
quirúrgica, el tratamiento apropiado es la extirpación completa de los mismos.
Cuando el contenido del quiste es estéril y no contiene bilis, su decapsulación y el establecimiento de una comunicación libre con la cavidad peritoneal es un procedimiento satisfactorio. El contenido purulento obliga al drenaje externo o la marsupialización.
En los pacientes con enfermedad poliquística del hígado y afección renal grave está contraindicada la escisión de los quistes hepáticos.
Cuando el sujeto se encuentra en buen estado de salud y sus síntomas guardan relación con el efecto de masa, está justificada incluso la escisión parcial.
PRONOSTICO. El pronóstico de la enfermedad poliquística es básicamente el que conlleva la enfermedad renal. Son raras la insuficiencia hepática, ictericia y las manifestaciones de hipertensión portal.
TUMORES BENIGNOS
HAMARTOMA. Los hamartomas constan de tejidos normalmente presentes en el órgano pero con una disposición desordenada. Las lesiones varían desde pequeñísimos nódulos hasta grandes tumores y raras veces tienen importancia clínica.
En los niños, los grandes hamartomas parenquimatosos se han presentado como masas abdominales de crecimiento rápido. Desde el punto de vista macroscópico, los tumores son firmes, nodulares, y localizados inmediatamente debajo de la superficie hepática, y pueden ser solitarios o múltiples. Casi siempre están bien encapsulados y con frecuencia son quísticos. En los pacientes con lesiones de importancia clínica, en general está indicada la escisión quirúrgica. Las lesiones situadas en partes profundas no se extirpan después del diagnóstico histológico, ya que no crecen con rapidez y no experimentan transformación maligna.
ADENOMA. En el pasado, los adenomas hepáticos eran extremadamente raros. En la actualidad, al parecer, son más comunes. Se notificó una relación entre la hemorragia intraperitoneal de estas lesiones y los anticonceptivos. Pero no se ha establecido la relación entre adenoma y estrógenos, progesterona o una combinación de estos.
Se presenta en hombres y mujeres que nunca han tomado medicamentos anticonceptivos. Sin embargo, casi todos los pacientes notificados han sido mujeres que reciben anticonceptivos orales.
Se ha documentado la regresión tras la suspensión de los medicamentos. Esto es cierto sobre todo en quienes presentan hemorragia intraperitoneal.
La TAC por lo general demuestra la lesión, la cual en el angiograma es hipervascular.
La resección está indicada en tumores que sangran o aumentan de tamaño. Los sujetos con adenomas asintomáticos deben observarse, suspenderles los anticonceptivos y se hace seguimiento de la lesión mediante tomogramas periódicos.
HIPERPLASIA NODULAR FOCAL (HNF). No se ha demostrado una correlación estadísticamente significativa entre los anticonceptivos orales y la HNF.
La lesión representa una respuesta a la agresión a las células hepáticas.
Los tumores por lo general son solitarios y a menudo se encuentran cerca del borde libre del hígado. Son de color cobrizo, casi siempre sin una cápsula y tienen una cicatriz estrellada central.
La mayor parte de las HNF no producen síntomas y raras veces se rompen. El diagnóstico se establece mediante la demostración angiográfica de una lesión estrellada. La resección solo está indicada cuando los síntomas guardan relación con el tumor.
HEMANGIOMA. El hemangioma es el nódulo hepático más común y el hígado es el órgano interno al que con mayor frecuencia afecta.
El tumor es cinco veces más común en la mujer que en el hombre.
No experimentan degeneración maligna, pero deben distinguirse de un hemangioendotelioma o una hemangiomatosis difusa. Esta última consiste en lesiones multicéntricas y difusas que se acompañan de afección vascular de la piel y se presentan en niños con manifestaciones clínicas en la primera semana de vida.
A veces es evidente una masa. El dolor guarda relación con las lesiones grandes. La mayoría de los pacientes se mantienen asintomáticos. Muy pocas veces se llega a escuchar un soplo. La principal complicación es la rotura con hemorragia intra-peritoneal, que es más frecuente en los niños y en mujeres gestantes. Los grandes tumores en los lactantes se asocian con insuficiencia cardiaca de alto gasto.
La arteriografía hepática selectiva es la técnica diagnóstica que proporciona mayor información. La ultrasonografia, la TAC y la resonancia magnética nuclear permiten definir un hemangioma intrahepático. La biopsia por punción percutánea, con control radiográfico o laparoscópico, es diagnóstica pero se asocia con la complicación de hemorragia.
En ocasiones con la adición de esteroides, la lesión experimenta regresión.
En raros casos es necesaria la ligadura de la arteria hepática para tratar la insuficiencia cardiaca. En los adultos, no debe extirparse casi ningún hemangioma
hepático. Incluso en las lesiones grandes en las que se hizo seguimiento por periodos prolongados no se demostró algún aumento notable en el tamaño o en las manifestaciones clínicas.
La posibilidad de su rotura es mínima y constituye una indicación para su escisión. El dolor, el efecto de masa, el crecimiento significativo y la perforación son
indicaciones para la escisión quirúrgica.
TUMORES MALIGNOS
CARCINOMA PRIMARIO
FRECUENCIA. Esta enfermedad es muy común entre los habitantes aborígenes de Africa y de ciertas partes de Asia. Las tasas en los estudios de necropsia en Estados Unidos promedian 0.27 %, en tanto que en Africa, son de 1.1 %, y los carcinomas hepáticos representan 17 a 53% de todos los cánceres.
El carcinoma primario del hígado es más frecuente en los hombres. En el caucásico es raro antes de los 40 años de edad, en tanto que en los africanos e indonesios, el padecimiento afecta sobre todo a los jóvenes, y por lo general se presenta antes de los 40 años de edad
Se encuentra una mayor frecuencia en los sujetos chinos aun después que cambian de residencia.
En los niños, la neoplasia suele aparecer antes de los dos años de edad y representa el carcinoma más común en los primeros años de vida. El hepatoblastoma por lo general afecta a menores de dos años de edad. Esta lesión también se presenta en los adultos.
El carcinoma fibrolamelar, una variante del carcinoma hepatocelular, tiende a
afectar a adolescentes y adultos jóvenes.
ETIOLOGIA. Se han implicado diversos factores etiológicos. Las aflatoxinas del hongo Aspergillus Flavus contaminan la dieta en las comunidades africanas y asiáticas en las que es muy frecuente el carcinoma hepatocelular.
Otros factores son la escasa ingestión de proteínas y el kwashiorkor consiguiente. Casi cualquier otro tipo de cirrosis puede acompañarse de carcinoma hepático, de manera que se observa una asociación definida entre la cirrosis y el carcinoma primario en el ser humano. La cirrosis postnecrótica es la variante que con mayor frecuencia precede al carcinoma hepatocelular; la cirrosis ocurre en 60 % de los casos. Los tumores malignos hepáticos se presentan en 4.5 % de los cirróticos y esta tasa aumenta en los que tienen hemocromatosis.
Se ha considerado que la infestación parasitaria con la duela hepática Clonorchis sinensis es un factor que interviene en el desarrollo del colangiocarcinoma, pero todavía
hay dudas al respecto. No hay mayor riesgo de carcinoma hepático tras la hepatitis infecciosa por virus A.
En los niños, el tumor raras veces guarda relación con la cirrosis.
ANATOMIA PATOLOGICA. El carcinoma hepatocitico (hepatocelular) es el tipo más común; las células tumorales semejan a la célula parenquimatosa. Al parecer el carcinoma de vías biliares (colangiocarcinoma) deriva del epitelio del conducto biliar.
El hepatoblastoma representa una variante inmadura del carcinoma de células
hepáticas.
En el examen macroscópico cada uno de estos tipos se presenta como un gran nódulo solitario, una nodularidad considerable o una afección difusa de todo el órgano
Los carcinomas hepatocelulares tienen una estructura trabecular y una manifestación notable es su vascularidad. Estas lesiones a menudo invaden ramas de la vena porta y a veces las hepáticas.
Los tumores hepáticos se diseminan por cuatro mecanismos:
1. El crecimiento centrífugo, implica expansión nodular que da lugar a la compresión del tejido hepático contiguo.
2. La diseminación parasinusoidal alude a la invasión tumoral hacia el parénquima circundante, ya sea a través de los espacios parasinusoidales o de los sinusoides mismos.
3. La diseminación venosa es la extensión del tumor a partir de las pequeñas ramas del sistema porta en forma retrógrada, hacia las ramas mas grandes y por último hacia la vena porta principal. La invasión de las tributarias de la vena hepática es menos común pero puede extenderse hasta la vena cava inferior o la aurícula derecha.
4. Las metástasis a distancia son el resultado de la invasión de los conductos linfáticos y sistemas vasculares. Los sitios afectados con mayor frecuencia son los ganglios linfáti-cos regionales y los pulmones.
Ocurren metástasis en 48 a 73% de los casos.
MANIFESTACIONES CLINICAS. La pérdida de peso y la debilidad se presentan en 80 % de los casos, en tanto que el dolor abdominal ocurre en la mitad.
El dolor suele ser vago y persistente, pero puede ser de inicio súbito y espectacular en pacientes con hemorragia intraperitoneal consecutiva a la rotura de un nódulo necrótico o erosión de un vaso sanguíneo.
Son raras las várices sangrantes.
El hígado casi siempre está aumentado de tamaño pero no siempre es doloroso. La esplenomegalia se encuentra en un tercio de los casos.
La frecuencia de la ictericia varía de 20-58%.
La ascitis se desarrolla en la mitad a tres cuartas partes de los pacientes.
Un aumento rápido en los síntomas y los signos, en un paciente con cirrosis, es muy sugestivo de un carcinoma hepático superpuesto.
En más de la mitad de los casos pediátricos la primera manifestación es una masa abdominal. La hemihipertrofia y la precocidad sexual se presentan en uno que otro niño con hepatoblastoma.
ESTUDIOS DIAGNOSTICOS. Las pruebas de funcionamiento hepático que más a menudo se alteran son la Bromosulfonftaleína (BSP) y la fosfatasa alcalina. La concentración de bilirrubina en el suero suele ser normal; la 5 nucleotidasa casi siempre está elevada.
La demostración de alfa-fetoproteína (AFP) en el suero mediante técnicas de inmunodifusión, inmunoelectroforesis e inmunoensayo es útil en el diagnóstico diferencial y en los estudios epidemiológicos. Esta proteína normalmente se encuentra en el feto.
| SINTOMAS Y SIGNOS AL MOMENTO DE LA HOSPITALIZACION EN EL CANCER EPITELIAL PRIMARIO EN ADULTOS: Masa Dolor Pérdida de peso Malestar epigástrico Hemorragia intraperitoneal Hepatomegalia Fiebre Hallazgo incidental en la laparotomía por otra enfermedad Diarrea Anorexia Náusea y vómito Debilidad, malestar Diagnóstico erróneo de colecistitis Síntomas endocrinos Prurito Ictericia Calcificación en las radiografías Biopsia por punción para enfermedad benigna Pruebas de funcionamiento hepático anormales Gammagrafía anormal |
Modificado de: Foster J, Berman M: Solid Liver Tumors, Philadelphia, Saunders, 1977, vol XXII.
Se observan pruebas de AFP positivas en casi 75% de los africanos pero sólo en
30% de los pacientes estadounidenses y europeos. La resección del tumor convierte la prueba en »negativa»; la recurrencia se detecta por la reaparición de AFP en el suero.
Se ha utilizado la arteriografía hepática selectiva para demostrar una imagen arterial en el tumor, que se caracteriza por estancamiento y aumento de la vascularidad. La gammagrafía también ayuda a identificar las masas en el hígado, pero la TAC y la
resonancia magnética nuclear son más sensibles. La biopsia por punción percutánea permite establecer un diagnóstico definitivo. La ultrasonografía es de particular utilidad para diferenciar al tumor quístico del sólido. La ultrasonografía transoperatoria ha constituido un refinamiento quirúrgico importante y ha permitido resecciones más limitadas.
TRATAMIENTO. El único tratamiento curativo es la escisión quirúrgica. En la mayor parte de los casos esto implica una lobectomía, pero a medida que se ha conocido más la anatomía segmentaria, cada vez son más frecuentes las resecciones »anatómicas» de menor magnitud. La cirrosis es un riesgo para una resección mayor en virtud de la elevada vascularidad, aumento en la morbilidad y la imposibilidad de regeneración del hígado cirrótico.
Ni la radioterapia ni la quimioterapia son curativas, pero la combinación de estas modalidades terapéuticas en los niños con hepatoblastoma ha hecho que lesiones no resecables se puedan extirpar y, en algunos casos, se ha logrado la curación. La infusión
arterial directa de agentes quimioterápicos ha logrado una reducción en el tamaño del tumor y un aumento en la sobrevida en casi 25% de los casos.
PRONOSTICO. El pronóstico en los pacientes con carcinoma primario hepático no tratados es muy desfavorable y la duración de la enfermedad raras veces es de más de cuatro meses a partir del tiempo de inicio de los síntomas. Los enfermos fallecen por caquexia, insuficiencia hepática, secuelas de trombosis de la vena porta, hemorragia intraperitoneal y metástasis. En los niños menores de dos años de edad con hepato-blastoma, el pronóstico con una terapéutica apropiada mejora. En los adultos, se han notificado tasas de sobrevida a cinco y a l0 años, después de la ablación quirúrgica del tumor, de 36 y 33 %, respectivamente.
Otras neoplasias primarias
Las tres principales lesiones son sarcoma, mesenquimoma y hemangioendotelioma infantil. Todas las lesiones mesenquimatosas hepáticas se consideran malignas.
El angiosarcoma es el sarcoma primario más común del hígado. Hay quienes consideran como factores etiológicos la exposición al cloruro de vinilo y la inyección
de torotrast.
El angiosarcoma se caracteriza por enfermedad breve, ictericia y coma que progresa con rapidez a la muerte.
Los hemangioendoteliomas infantiles se presentan en niños menores de cinco años de edad y se asocian con lesiones cutáneas e insuficiencia cardiaca consecutiva a fístulas arteriovenosas dentro del tumor. Aunque casi todas estas lesiones pediátricas son mortales, se ha registrado una regresión espontánea y buenos resultados con la hepatectomía parcial.
Neoplasias metastásicas
Estas representan el tumor maligno más común del hígado. La proporción relativa de neoplasias primarias a secundarias se calcula en 1:20.
El hígado, después de los ganglios linfáticos regionales, es el segundo sitio más frecuente de metástasis de tumores, y 25 – 50% de quienes fallecen por cáncer han resultado con metástasis hepáticas. Cincuenta por ciento de los pacientes con tumores gastrointestinales tienen metástasis hepáticas en la necropsia.
Las neoplasias metastásicas llegan al hígado a través de cuatro vías: 1) vena porta, 2) diseminación linfática, 3) sistema arterial hepático y 4) diseminación directa.
Las metástasis se presentan en el hígado en tiempos variables con respecto a las lesiones primarias: 1) son evidentes las metástasis rápidas cuando no se sospecha la lesión primaria (carcinoide del ileon). 2) Ocurren metástasis sincrónicas cuando se detecta neoplasia hepática al mismo tiempo que la lesión primaria. 3) Las metástasis
metacrónicas son aquellas en las que la aparición del tumor se demora tras la extirpación satisfactoria de un tumor primario (melanoma ocular, colon).
MANIFESTACIONES CLINICAS. Los síntomas atribuidos al hígado se presentan en 67% de los pacientes con metástasis demostradas e incluyen dolor hepático, ascitis con ictericia, anorexia y pérdida de peso. En el examen, es evidente la nodularidad hepática en la mitad de los casos y en 10% se escucha un frote de fricción. En aproximadamente un cuarto a un tercio de los sujetos ocurre ictericia, ascitis y los signos de hipertensión portal. En los tumores carcinoides, las metástasis hepáticas tienen primordial importancia en la patogénesis del síndrome ruborizante.
ESTUDIOS DIAGNOSTICOS. Las concentraciones de fosfatasa alcalina se encuentran elevadas en más de 80% de los casos. La TGOS está elevada en alrededor de dos tercios, pero la determinación de alfa-fetoproteína en el suero es negativa. El antígeno carcinoembrionario constituye un marcador para el carcinoma colónico metastático.
La combinación de TAC, resonancia magnética nuclear y angiografía es lo que mejor define la presencia, la localización y si son operables las lesiones. La ultrasono-grafía transoperatoria ha ayudado a definir las lesiones resecables.
TRATAMIENTO. El tratamiento quirúrgico de las metástasis hepáticas sólo debe considerarse cuando: 1) se logra o se prevé el control del tumor primario, 2) no hay metástasis sistémicas o intraabdominales, 3) el estado del paciente tolerará el procedimiento quirúrgico mayor y 4) la magnitud de la afección hepática es tal que es factible la resección y la extirpación total de las metástasis. La resección de segmentos hepáticos que contienen metástasis ha logrado tasas de sobrevida a largo plazo aceptables sin recurrencia en pacientes con cánceres primarios en el colon y el recto y en los que tienen tumor de Wilms.
Las metástasis que se encuentran durante una resección del colon deben extirparse en ese momento, si es factible hacerlo sin que se pierda mucha sangre. Sin
embargo, si resulta necesaria una resección hepática mayor, la operación se post-pone algunos meses y antes de efectuarla se lleva a cabo TAC y angiografía para valorar si son resecables.
En servicios muy especializados se obtuvo una tasa de sobrevida a cinco años de casi 40 % en pacientes que habían sido sometidos a escisión local de metástasis hepáti-cas pequeñas provenientes de cáncer colorrectal.
Las medidas quirúrgicas paliativas están indicadas en quienes aquejan dolor intenso asociado con neoplasias hepáticas y para la escisión de metástasis en caso de síndrome ruborizante del tumor carcinoide.
La resección de la porción principal de las metástasis hepáticas (procedimiento de reducción del tumor), ha dado lugar a mejoría sintomática significativa y reducción de las concentraciones del ácido hidroxiindolacético (5-HIAA) a lo normal. Estos cambios subjetivos y objetivos han persistido por varios años.
La ligadura de arterias y la embolización con control radiográfico han logrado resultados similares.
Con la infusión arterial hepática de Floxuridina (FUDR) y mitomicina C se obtiene mejoría sintomática y datos objetivos de reducción del tamaño de las metástasis hepáticas de carcinomas colorrectales. La infusión se lleva a cabo mediante la colocación percutánea del catéter. Ultimamente los pacientes han aceptado una bomba
recargable percutánea; se implanta en el tejido subcutáneo y se adhiere a un catéter que se coloca en la arteria hepática mediante una operación. Esto permite la infusión intra-arterial prolongada de agentes quimioterápicos.
ANATOMIA SEGMENTARIA DEL HIGADO
FUNDAMENTACION DE LA ANATOMIA SEGMENTARIA DEL HIGADO
Desde el inicio de los estudios anatómicos se distinguió un lóbulo hepático derecho y uno izquierdo cuyos limites están trazados por el ligamento falciforme y el ligamento redondo. Estos límites son arbitrarios, pues la arquitectura interna del hígado muestra también una partición del órgano en dos mitades, pero el límite corre desde el borde derecho de la vesícula hasta el borde izquierdo de la vena cava, es la línea vesículo biliar-cava o línea de Seregé-Cantlié.
Las mitades hepáticas (lóbulos) se dividen en cuatro segmentos cada una.
Quienes estudiaron intensivamente la división intrahepática y pudieron determinar la segmentación sobre la base de la anatomía vascular y biliar fueron Ch. Hjortsjö, H. Elías y Couinaud.
Distinguimos pues una mitad hepática derecha y una mitad hepática izquierda. El lóbulo caudado, (segmento I) por su irrigación vascular pertenecería a ambas mitades.
La arteria hepática, el conducto hepático y la vena porta (pedículo glissoniano), penetran al hígado por el hilio hepático, dividiéndose inmediatamente en un ángulo que alcanza los 180º, proveyendo de este modo de un pedículo a cada una de las dos mitades hepáticas.
Estos pedículos se extienden por una superficie horizontal que divide a las dos mitades hepáticas en un segmento craneal y un segmento caudal respectivamente.
Las venas suprahepáticas determinan una división vertical. Existen tres grandes venas suprahepáticas: la vena hepática media o sagital, que discurre por la línea vesícula biliar-cava, formando el eje del medio del órgano y las venas hepáticas derecha e izquierda que discurren en dirección parasagital por la correspondiente mitad del hígado, dividiéndolas a cada una de ellas en un segmento paramediano y uno lateral.
Las venas suprahepáticas dividen al hígado en cuatro sectores verticales, que a su vez son divididos cada uno de ellos por la superficie de extensión horizontal de las formaciones del hilio, en segmento craneal y caudal respectivamente.
De esta manera se originan ocho segmentos, dichos segmentos reciben distintas denominaciones según los distintos autores.
| REIFFERSCHEID | COUINAUD | HJORSTJÖ | HEALEY Y SCHROY |
| SEGM. CRANEOLATERAL DERECHO | VII | DORSOCRANEAL + SEGM. INTERMEDIOCRANEAL | ZONA POSTEROSUPERIOR |
| SEGM. CAUDOLATERAL DERECHO | VI | DORSOCRANEAL + SEGM. INTERMEDIOCAUDAL | ZONA POSTEROINFERIOR |
| SEGM. CRANEO PARAMED. DERECHO | VIII | SEGM. VENTROCRANEAL | ZONA ANTEROSUPERIOR |
| SEGM. CAUDO PARAMED. DERECHO | V | SEGM. VENTROCAUDAL | ZONA ANTEROINFERIOR |
| LOBULO CAUDADO | I | SEGM. DORSAL | LOBULO CAUDADO |
| SEGM. CRANEO PARAMED. IZQUIERDO | IV | SEGM. CENTRAL | ZONA MEDIA SUPERIOR |
| SEGM. CRANEO PARAMED. IZQUIERDO(LOBULO CUADRADO) | IV | SEGM. DORSOVENTRAL | ZONA MEDIA INFERIOR |
| SEGM. CRANEOLATERAL IZQUIERDO | II | SEGM. DORSOLATERAL | ZONA LATEROSUPERIOR |
| SEGM. CAUDOLATERAL IZQUIERDO | III | SEGM. VENTROLATERAL | ZONA LATEROINFERIOR |
CLASE DE HIGADO Y VIAS BILIARES
El hígado está situado en la parte superior del abdomen, pesa aproximadamente 1500 gs en el cadáver y 500 gs más en el vivo; se mantiene en su posición por la vena cava inferior y venas suprahepáticas, ligamento coronario y ligamentos triangulares, ligamento redondo y suspensorio.
Forma
Puede ser comparado a un ovoide de eje mayor transversal al que se le saca la parte inferior mediante una incisión oblicua.
Cara anterosuperior
Dividida por el ligamento suspensorio en dos lóbulos, derecho e izquierdo; está en Relación con el diafragma y por medio de este con el corazón y las pleuras. Por arriba su borde superior se proyecta a la altura de la quinta costilla en la espiración, por abajo rebasa el reborde de las costillas falsas en una medida variable, durante la inspiración.
Cara posteroinferior
Cóncava, En ella se reconoce un surco izquierdo formado por el resto embrionario de la vena umbilical y el cordón fibroso del conducto venoso de Arancio.
Surco derecho formado por la vesícula biliar y la vena cava.
Surco transverso: da entrada al pedículo hepático, es el hilio del hígado. Divide la cara inferior en lóbulo cuadrado, lóbulo caudado, lóbulo derecho y lóbulo izquierdo.
El lóbulo derecho tiene 3 facetas: Cólica, renal y suprarrenal.
Lóbulo izquierdo: Gástrica.
Borde anterior
Delgado, cortante, en relación con las falsas costillas derechas, el hueco epigástrico y la sexta o séptima costilla izquierda; tiene dos escotaduras, una, la de la vesícula biliar y otra la del ligamento suspensorio.
Borde posterior
En Relación con el diafragma, columna vertebral (escotadura), vena cava, aorta, esófago. A nivel del borde posterior se inserta el ligamento coronario.
Extremidad derecha
Voluminosa y convexa, en ella se inserta el ligamento coronario, formando el ligamento triangular derecho.
Extremidad izquierda
Delgada y aplanada, se extiende sobre la tuberosidad mayor del estómago, está sujeta al diafragma por el ligamento triangular izquierdo.
El hígado está cubierto por una cubierta fibrosa, la cápsula de Glisson, membrana delgada y transparente.
El peritoneo que lo cubre, además de los medios de fijación forma el ligamento gastrohepático o epiplon menor.
Vasos
Vena porta y sus ramas.
Arteria hepática, rama del tronco celíaco.
Vía biliar extrahepática
Conducto hepático
Nace en el hilio, de la convergencia biliar superior por la unión de los dos hepáticos, derecho e izquierdo; recorre el epiplon gastrohepático por delante y a la derecha de la vena porta; mide 5mm de diámetro y 3 cm de largo, término medio.
Vesícula biliar
Receptáculo membranoso y piriforme, puede llegar a medir hasta 10 o más cm de largo, puede contener por distensión hasta 200 cc de bilis.
Conducto cístico
Tortuoso y fino de aproximadamente 30 mm de largo.
Colédoco
Supraduodenal, retroduodenal, pancreático e intraparietal. Largo: 6 a 8 cm, diámetro: 6 a 10 mm, desemboca en la ampolla de Vater en la segunda porción del duodeno.
SEMIOLOGIA DEL HIGADO Y VIAS BILIARES
Edad
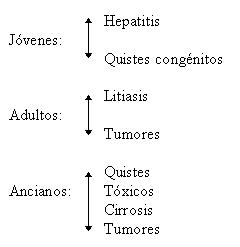
Sexo: Litiasis y discinesias, predominántemente femenino
MOTIVO DE CONSULTA

Determinar fecha de comienzo de los síntomas y duración.
Determinar forma de comienzo, brusca o lenta.
Sitio de dolor y mayor intensidad.
Hora del dolor: diurno, nocturno, Relación con la ingesta, sobre todo con grasas Irradiación: Al hombro homolateral, irradiación en tirante, etc. Posiciones antiálgicas
Náuseas: productivas o improductivas
Vómitos: Acto reflejo por el que se elimina el contenido gástrico, activa y violéntamente por la boca.
Biliosos, alimenticios, porraceos, hematemesis, ácidos, acuosos.
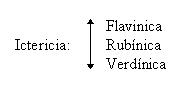
Coluria
Acolia
Prurito
Fiebre:
Colecistitis
Colangitis
Hepatitis
Distensión postprandial
Eructos
Pesadez
Rubicundez
Cefaleas
Intolerancia a colecistokinéticos
Astenia
Anorexia
ANTECEDENTES DE LA ENFERMEDAD ACTUAL
Averiguar: fecha de iniciación de los síntomas, si hubo cuadros anteriores similares, Relación con la ingesta de comidas, contactos con hepatíticos, inyectables, tóxicos (pintores, plomo, TNT, mercurio, arsénico)
ANTECEDENTES PERSONALES FISIOLOGICOS
Higiene, vivienda, antecedentes profesionales (enfermeros, médicos), tóxicos, convivencia en grupos, hábitos alimenticios, alcohol, berro (fasciola hepática), anticonceptivos orales, cloacas, agua corriente, agua de pozo, etc.
ANTECEDENTES PERSONALES PATOLOGICOS
Contacto con hepatitis, inyectables, sueros, transfusiones, hidatidosis, «diátesis urática», amibiasis, esquistozomiasis, aflatoxina (aspérgilus flavus)
ANTECEDENTES QUIRURGICOS
Operaciones sobre el aparato digestivo y vías biliares, vagotomías, etc.
ANTECEDENTES HEREDITARIOS
Litiasis biliar por trastornos metabólicos de lípidos y de pigmentos. Carcinoma de hígado y vías biliares, quistes congénitos de vías biliares como precursores de carcinoma de vías biliares.
Enfermedad de Gilbert: Hiperbilirrubinemia crónica ligera, menor de 3 mg %
Criggler Najjar: Gran ictericia por deficit de glucuronil transferasa, el tipo II es más benigno, disminuye la ictericia al administrar fenobarbital.
Dubin Johnson: aumento de la bilirrubina directa, ictericia intermitente, trastorno de la excreción por parte del hepatocito de aniones orgánicos, entre ellos bilirrubina.
Síndrome de Rotor: Semejante al Dubin Johnson, sin pigmentos en los hepatocitos
Colostasis intrahepática familiar recurrente benigna, enfermedad de Summerskille: Episodios de 3 o 4 meses, con anorexia, pérdida de peso, fosfatasa alcalina elevada, bilirrubina directa elevada, transaminasas elevadas.
EXAMEN FISICO
INSPECCION
Ictericia;
flavínica: B.D. normal, B.I. elevada
Verdínica: B.D. elevada, B.I. normal
Rubínica: B.D. Normal o elevada, B.I. elevada
Ictericia con tonalidad bronce o negro, en algunas formas crónicas donde existe bilirrubina que impregna los tejidos y pigmento melánico por la irritación prolongada.
Ver conjuntivas y lugares de presión, en la palmas de las manos, la región tenar.
Telangiectasias, rubíes, circulación colateral
Retracción palmar de Dupuytren
Eritema palmar: Por dilatacion vascular, predominante en región tenar e hipotenar
Edemas, ascitis, vientre batraciforme o en obus.
Tumoración en H.D., hepatomegalia.
Asimetría en caso de quistes hidatídicos hepáticos o metástasis o producida por hidropesía vesicular
Vello pubiano de distribución ginecoide, atrofia genital en el hombre, signos de rascado por prurito, estrías, ginecomastia, equímosis, gingivorragias, epistaxis
Flapping tremor en la insuficiencia hepática.
PALPACION
Se comienza en fosa ilíaca derecha y se termina en hipocondrio derecho Manos cálidas
Se efectúa primero palpación superficial, se detectan hepatomegalias, hiperestesias, cambios en el tono muscular.
Luego se realiza la palpación profunda:
I Borde hepático:
- cortante o romo
- nodular o liso, mov. respiratorios
- consitencia, dolor provocado, dolorabilidad, tamaño
II Vesícula biliar
- Aumentos de tamaño y sus desplazamientos, signo del badajo de campana, Ley de Curvoisier Terrier
- puntos dolorosos
III Zonas dolorosas de las vías biliares, puntos.
I Palpación del hígado: Normal, hasta 1 cm por debajo del reborde costal, paciente en decúbito dorsal, con o sin almohada debajo de las rodillas, cabeza ligeramente elevada con una almohada, medico a la derecha, manos tibias
Palpación superficial, Método de Gilbert: para hígados duros y de tamaño aumentado: Manos en ángulo de 45º, la derecha paralela y por fuera del recto anterior del abdomen, con las puntas de los dedos hacia arriba.
Palpación profunda:
Método de Mathieu o del enganche. Método de Chauffard: Del peloteo, mano izquierda en región costomuscular, mano derecha percibe el borde.
Palpación de Sir William Osler: Con las puntas de los dedos dirigidos a la axila izquierda
Método de Glenard: Mano izquierda en la región lumbar derecha del paciente, con la derecha deprime el abdomen, llevando las vísceras abdominales hacia el compartimiento superior. Con el pulgar izquierdo deprime el flanco derecho por debajo del reborde costal. Palpa el hígado en inspiración con el pulgar deslizándose de arriba a abajo y de fuera adentro.
Método de Brugsch: pone la mano izquierda hacia arriba y el pulgar izquierdo hacia adentro, palpa por enganche con la mano derecha.
Palpación por empuje: signo del témpano, en la ascitis.
La palpación permite delimitar el borde hepático, determinar si es cortante o romo, regular o irregular.
Deteminar consistencia: duro, blando, renitente.
Determinar superficie: lisa o nodular y a su vez si es micro o macro nodular, si los nódulos son únicos o múltiples.
Determinar sensibilidad.
II – Palpación de la vesícula biliar
Punto cístico: doloroso, en la unión del reborde costal derecho y borde externo del recto anterior del abdomen.
Signo de Murphy: Interrupción de la inspiración por aparición de dolor brusco a la palpación del punto cístico. Maniobra de Murphy: Paciente sentado en la cama, médico sentado detrás de este y a su derecha; levanta sus brazos y el examinador pasa los suyos poniendo las manos en el punto cístico. Hace una inspiración y al profundizar nuestros dedos se detiene la inspiración.
Maniobra de Pron: Colocados ambos pulgares por debajo del arco costal derecho, en el punto cístico, al hacer la inspiración, se corta por dolor.
Maniobra de Chiray: Paciente. en decúbito lateral izquierdo, con los muslos flexionados sobre la pelvis. El examinador situado detrás del mismo hunde la mano derecha debajo del reborde costal derecho, se provoca dolor a la inspiración.
Maniobra de Moynihan: Paciente. en decúbito supino, examinador a la derecha, se explora con el pulgar, dolor a la inspiración.
III.-Zonas dolorosas de las vías biliares.
Puntos
Punto cístico: doloroso, en la unión del reborde costal derecho y borde externo del recto anterior del abdomen.
Zonas hiperestésicas y dolorosas de Head
Corresponden en región frontal y dorsal a areas de distinta sensibilidad que se distribuyen desde la columna dorsal o desde el epigastrio. Corresponden a patología vesicular.
Zona pancreático-coledociana de Chauffard
Angulo correspondiente al interno, creado por la bisectriz de un ángulo formado por la línea media en su unión a nivel de ombligo con una transversal. Corresponde a procesos dolorosos de la cabeza del páncreas y litiasis coledociana.
Punto de Preioni
A 2 dedos sobre el ombligo, algo a su izquierda, constante en procesos agudos pancreáticos.
PERCUSION
Se realiza desde torax, se comienza en 2º o 3er espacio intercostal, en 5º espacio comienza submatidez y en el 6º, la matidez. Los abscesos subfrénicos y los quistes hidatídicos aumentan la matidez hacia arriba, se percute siguiendo la línea hemiclavicular y laterales. El neumotorax o el enfisema descienden el límite superior percutorio.
Percusión de ascitis:
En los flancos y fosas ilíacas, en forma radiada, con centro en ombligo, diferenciar en hipogastrio con vejiga retencionista, mioma y quiste de ovario.
Maniobra de percusión y palpación combinada en ascitis: para detectar onda líquida, se coloca una mano en la línea media, con otra se percute en el flanco derecho y el ayudante percibe onda líquida en el otro flanco cuando hay ascitis.
Percusión de bazo: en posición de Shuster, decúbito lateral derecho, algo inclinado en sentido dorsal, se percute suavemente siguiendo las costillas o los espacios intercostales, el eje mayor corresponde aproximadamente. a la 11a costilla.
AUSCULTACION
Soplos arteriales: aneurismas de la hepática.
Soplos venosos: por hipertensión portal, síndrome de Crouvellier Baumgarten. Frotes por abscesos o por despulimientos después de biopsia hepática.
MISCELANEAS Espacio Semilunar de Traube
Forma de casquete o semiluna.
Parte anterior izquierda de la base del tórax: Sonoridad timpánica aguda de estómago vacío, ausencia de murmullo vesicular y vibraciones vocales.
Límite inferior el reborde costal, límite superior y externo el reborde de la tuberosidad mayor.
Triángulo de Labbe
Corresponde a la parte inferior de la cara anterior del estómago. Borde externo es el reborde costal, borde interno corresponde al hígado, borde inferior es la curvatura mayor gástrica.
PRACTICAS COMPLEMENTARIAS
PRUEBAS DE LABORATORIO
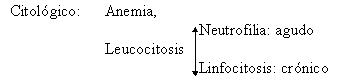
Eritrosedimentación acelerada
Glucemia
Uremia: falla hepato-renal
Creatinina
Colesterol: Elevado en las obstrucciones, baja en las insuficiencias hepáticas, descienden antes los ésteres
Fosfatasa alcalina, TGP TGO, Gamma glutamil transpeptidasa, 5 nucleotidasa, Leucilaminopeptidasa, Bilirrubinemia
Orina completa: pigmentos y sales biliares
Proteinograma por electroforesis. Albúmina baja en la falla hepática.
Tiempo de protrombina, Tiempo de hemorragia y coagulación
Estercobilina aumentada en las hemólisis.
Urobilinuria aumentada en las hemólisis (por mayor producción de bilirrubina), también cuando hay un tránsito intestinal prolongado y en la invasión bacteriana del intestino delgado.
Urobilinuria disminuida, cuando hay menos pasaje de bilirrubina al intestino (colestasis intra o extra hepática). También un descenso de la urobilinuria se puede producir en caso de tránsito intestinal acelerado.
En las hepatitis aumenta al principio, luego disminuye pues se produce menos bilirrubina y aumenta al final.
Alfa Fetoproteina muy elevada en los hepatomas: VN < 10 ng/cm3, en hepatomas > 300 ng/cm3.
Ante una hepatitis probablemente B se debe investigar el antígeno de superficie: HBSAg y el anticuerpo anticore, HBCAc(central). Al HBS se lo conoce también como antígeno australiano. En la hepatitis B activa, es positivo el anticuerpo contra el antígeno «e» de la hepatitis B.
Actualmente se investigan también anticuerpos específicos de la hepatitis A(IGM e IGG), de las hepatitis C,D,E, anticuerpos de la Hepatitis por virus de Epstein y Bar (tempranos y tardíos) y de la Hepatitis por Citomegalovirus
Pruebas funcionales:
Test de Bromosulfonftaleina, VN Retención < 5% a los 40 minutos
Test de Caroli: Que valora la rapidez de eliminación de bromosulfonftaleina por la vía biliar, mediante sonda duodenal, normalmente comienza a eliminarse a los 20 minutos de una inyección EV. En las hepatitis se acorta, en las obstrucciones de la vía biliar se alarga.
Prueba de la galactosa: Se administran 40 gs de galactosa oral en ayunas en 400 ml de agua, se recoge orina por 4 hs, la eliminación normal es menor de 3 gs pues el hígado normal lo convierte en glucosa
Sondeo duodenal: Prueba de Meltzer Lyon y Tiempos de Varela Fuentes. Este es un dato histórico, ya se ha dejado de hacer, tenía resultados equívocos, no siempre objetivables.
Sonda semirrígida de Camus o de Einhorn, provista de un extremo visible a los Rx.
Se coloca en 2a porción de duodeno. Obtención al aspirar con la jeringa, de un líquido transparente, algo viscoso, de color y aspecto parecido al aceite de oliva. Se recogen unos ml para el análisis (Bilis A). A continuación se instilan 50 ml de sulfato de magnesio al 33 %, que cierra el píloro, relaja el Oddi y estimula la contracción vesicular, Se aspira nuevamente el líquido con la misma jeringa. Después de 5 a 10 minutos, de manera brusca comienza a fluir un líquido transparente, de color pardo oscuro mucho más pigmentado que la bilis anterior, esta es la bilis B , de la que se expulsan 20 a 50 ml.
Después fluye de sonda un líquido amarillo pálido mezclado con líquido gástrico, que lo enturbia, bilis C. En bilis A y B se realizan estudios bioquímicos microscópicos y bacterianos.
DIAGNOSTICO POR IMAGENES
Rx. directa de abdomen, de escaso valor, solo para imágenes cálcicas; signo de Simón en colecistitis gangrenosas.
Imágenes de asas intestinales dilatadas en el ileo biliar, que es un ileo mecánico u obstructivo producido por el pasaje de un cálculo a intestino delgado por una fístula colecisto yeyunal, o colecisto-duodenal.
Colecistografía oral: No hacer en pacientes con hiperbilirrubinemia, eritrosedimentación acelerada, cuadros agudos o enzimas hepáticas elevadas. Si da vesícula excluida, hacer otra placa directa a las 24 hs, casi no se utiliza este estudio actualmente, solo encuentra utilidad en servicios especializados que realizan evacuación percutánea de la vesícula biliar en pacientes de alto riesgo y para su control ulterior.
Colangiografía E.V.: en vesículas excluidas a los Rx por el método oral, aún en pacientes con leve elevación enzimática o con hiperbilirrubinemia menor de 2 mg%. No se hace actualmente, pues no existe el medio de contraste en el mercado. Por otra parte era un estudio de resultados aleatorios, con dificil visualización de la vía biliar extrahepática.
Ecografía: Actualmente es el primer estudio que se pide pues no está limitado por la elevación enzimática, bilirubinemia o cuadro agudo.
T.A.C.: Es un método de alta resolución más costoso; detecta aún pequeños tumores pediculares o lesiones intraparenquimatosas.
R.M.N.: Más costoso que el anterior, pero aun de mayor resolución, actualmente ha incrementado sus indicaciones para la visualización nítida de lesiones intraductales y parenquimatosas, llegándose hasta tal punto en su aplicación, que en centros especializados de cirugía hepatobiliar se considera como innecesario la instrumentación de la vía biliar por endoscopía, salvo que ya se haya demostrado litiasis coledociana.
Colangiopancreatografía endoscópica retrógrada: Ideal para aclarar obstrucciones pediculares o hiliares, sin vía biliar dilatada, también cuando se estudian obstrucciones biliares en pacientes con coagulopatías o en ascitis graves. Como es útil para evaluar el duodeno y la zona ampular, facilita el diagnóstico de tumores periampulares y pancreatitis crónica, permite además biopsias y en casos especiales, citología por cepillado.
Método invasivo: es la colangiografía trans-parietohepáticaC.T.P.H., en obstrucciones, preferiblemente después de una ecografía que de indicios de una vía biliar dilatada, permite además la degravitación de la vía biliar e incluso la colocación de catéteres. Método de Molnar.
La C.T.P.H fue el inicio para llegar a la descompresión de la vía biliar intra y extrahepática, mediante catéteres (stents), o prótesis expansibles que se usan en la actualidad por vía percutanea o por vía endoscópica.
La C.T.P.H. requiere protrombina con valores superiores al 70 % o sinó debe prepararse al paciente mediante vitamina K por vía parenteral.
Gammagrafía de hígado y vías biliares: con imino diacético (macromolécula) HIDA y 99Tc, en 15′, 20′, 40′ y hasta en 20 Hs, en casos de pasaje retardado.
También se puede hacer con 189Au coloidal, bromosulfaleina marcada con 131I, o con polivinilpirrolidona marcada con 113In, o verde de indocianina marcado con 113In.
Arteriografía selectiva con catéter de Seldinger, permite en ocasiones realizar diagnóstico diferencial entre quistes y tumores. También tiene su indicación para definir la anatomía vascular intrahepática, previo a una cirugía de resección y para valorar el compromiso vascular por tumores primarios y secundarios.
Laparoscopía, biopsia percutánea, biopsia laparoscópica y actualmente videolaparoscópica.
Terapéutica médica del cuadro de colecistitis aguda: o se opera en pocas horas o días, o se espera 60 días.
Terapéutica Quirúrgica
En algunos cuadros agudos con bloqueo de la convergencia biliar inferior, solo colecistostomía.
Lo ideal es la colecistectomía, se realiza la colangiografía intraoperatoria. Actualmente existe la opción de la colecistectomía videolaparoscópica. Si hay litiasis coledociana se realiza coledocotomía, litoextracción y cierre de la coledocotomía sobre tubo de Kehr.
Esta operación ya se hace por vía laparoscópica. Si hay litiasis papilar se realiza papilotomía transduodenal, pero actualmente existe la opción de la papilotomía endoscópica.
Si hay vía biliar dilatada y estenosis orgánica, o funcional marcada, en pacientes añosos, se realiza colédoco-duodeno-anastomosis. En las litiasis vesiculares colesterínicas se intenta realizar su destrucción con ácidos biliares como el quenodesoxicólico. También se intenta tratamiento con ondas ultrasónicas extracorporeas.
En los tumores hepáticos se realizan hepatectomías derechas o izquierdas simples o ampliadas.
En los tumores de la vía biliar, resecciones hepáticas que comprenden lóbulos, sectores o segmentos, asociadas a resecciones parciales, segmentarias, de la vía biliar y anastomosis con yeyuno, calibrados o no con tutores multiperforados.
En los tumores irresecables de la vía biliar principal o de la vesícula biliar, intubación trans-tumoral trans hepática, realizadas por vía laparotómica, percutánea o o endoscópica.
Actualización
En la profilaxis de la hepatitis B, se realiza la vacunación con tres dosis a los integrantes de los grupos expuestos, entre los que s se halla el personal de salud.
En el tratamiento de las hepatitis virales tipo C crónicas, se estableció que aquellos que respondieron al primer curso de terapia con Interferón, responderían a un segundo curso. Pero la mayoría de los pacientes están expuestos a una reactivación finalizado aquel, habiéndose observado que los cambios mutacionales en el genoma del HCV, que lleva al desarrollo de quasispecies, puede ser la causa de la recidiva.
La dosis utilizada puede tan solo suprimir la replicación viral, pero al final del tratamiento el virus podría permanecer en el hígado o en sus reservorios extrahepáticos.
El interferón alfa se utiliza en dosis que varían de 1.500.000 Unidades a 10.000.000 de Unidades en períodos de 3 meses en dosis progresivas. El Consensus lnterferón es un nuevo Interferón tipo I, que permite la administración de dosis más altas, de 3 a 15 millones de unidades 3 veces por semana durante 6 meses , con una respuesta durable, con negatividad persistente del HCV RNA en suero de los pacientes.
Colangitis o Colangiopatía autoinmune. Esta entidad clínica pertenece al grupo de las enfermedades hepáticas colestáticas de probable origen autoinmune, comparte características clínicas con la cirrosis biliar primaria, pero presenta anticuerpos antinucleares positivos, antimitocondriales negativos. La colangiopatía autoinmune responde en mayor medida a los inmunomoduladores y al ácido ursodesoxicólico que la CBP.
TRAUMATISMOS HEPATICOS
El hígado pese a estar protegido por las costillas, sufre en muchas ocasiones los traumatismos directos o por contragolpe.
Frecuencia: es la víscera que más frecuentemente se ve lesionada después del bazo. Etiología
Traumatismos cerrados: producidos por accidentes de automóviles, agresiones con objetos romos, coz de caballo.
Traumatismos abiertos: Producidos por armas blancas, vidrios, chapas, o por armas de fuego.
Clasificación anatomopatológica
Ruptura con desgarro
Ruptura subcapsular
Ruptura central
Estallido:producidas generalmente por proyectiles de alta velocidad.
MANIFESTACIONES CLINICAS:
El derrame de sangre en la cavidad peritoneal produce síntomas de:
Shock hipovolémico.
- Hipotensión
- Taquicardia
- PVC baja
- Débito urinario disminuido
Iritación peritoneal
- Distensión
- Contractura
Laboratorio
- Leucocitosis, Descenso del Hematocrito.
- Hiperbilirrubinemia ligera
Radiología
- Fracturas costales
- Hepatomegalia
- Diafragma elevado
- Banda opaca, ancha en parietocólico derecho
Ecografía: Líquido en cavidad
Centellografía: Hematoma central
TRATAMIENTO
Laparotomía: detener la hemorragia
Sacar el tejido hepático desvitalizado
Tratar el shock y las lesiones torácicas previamente a la operación
Dejar drenajes en cavidad
Ante una hemorragia arterial o venosa se prefiere realizar una ligadura directa en lugar de puntos de colchonero pues estos producen necrosis adicional de tejidos y el riesgo de hemobilia o abscedación.
LESIONES DE LAS SUPRAHEPATICAS
Producen rapidamente shock, debe buscarse mediante una amplia exposición el sitio de sangrado, comprimir con compresas hasta poder hacer una sutura adecuada de la o las venas lesionadas, debe hacerse en estos casos un muy rápido aporte de volumen.
LESIONES DE LA VENA PORTA
Requieren de sutura directa, prótesis, o cortocircuitos con el sistema de la vena cava. Complicaciones: Sepsis, Hemorragias secundarias, abscesos
RUPTURA ESPONTANEA DEL HIGADO
Etiología: Toxemia del embarazo, tumores, quistes, fiebre tifoidea, arteritis obliterante. La ruptura del hígado en recién nacidos está relacionada a sobrepeso y a partos difíciles
HEMOBILIA
Se produce por comunicación anormal entre un vaso sanguíneo y el árbol biliar
Etiología: Traumatismo u operación
Síntomas:
- Dolor cólico
- Hemorragia digestiva
- Ictericia intermitente
Diagnóstico por imágenes:
- Ecografía, centellografía
- Arteriografía
Tratamiento:
- Resección de la Lesión
- Ligadura de la rama
- Segmentectomía