El hígado está situado en la parte superior del abdomen, pesa aproximadamente 1500 gs en el cadáver y 500 gs más en el vivo; se mantiene en su posición por la vena cava inferior y venas suprahepáticas, ligamento coronario y ligamentos triangulares, ligamento redondo y suspensorio.
Forma
Puede ser comparado a un ovoide de eje mayor transversal al que se le saca la parte inferior mediante una incisión oblicua.
Cara anterosuperior
Dividida por el ligamento suspensorio en dos lóbulos, derecho e izquierdo; está en Relación con el diafragma y por medio de este con el corazón y las pleuras. Por arriba su borde superior se proyecta a la altura de la quinta costilla en la espiración, por abajo rebasa el reborde de las costillas falsas en una medida variable, durante la inspiración.
Cara posteroinferior
Cóncava, En ella se reconoce un surco izquierdo formado por el resto embrionario de la vena umbilical y el cordón fibroso del conducto venoso de Arancio.
Surco derecho formado por la vesícula biliar y la vena cava.
Surco transverso: da entrada al pedículo hepático, es el hilio del hígado. Divide la cara inferior en lóbulo cuadrado, lóbulo caudado, lóbulo derecho y lóbulo izquierdo.
El lóbulo derecho tiene 3 facetas: Cólica, renal y suprarrenal.
Lóbulo izquierdo: Gástrica.
Borde anterior
Delgado, cortante, en relación con las falsas costillas derechas, el hueco epigástrico y la sexta o séptima costilla izquierda; tiene dos escotaduras, una, la de la vesícula biliar y otra la del ligamento suspensorio.
Borde posterior
En Relación con el diafragma, columna vertebral (escotadura), vena cava, aorta, esófago. A nivel del borde posterior se inserta el ligamento coronario.
Extremidad derecha
Voluminosa y convexa, en ella se inserta el ligamento coronario, formando el ligamento triangular derecho.
Extremidad izquierda
Delgada y aplanada, se extiende sobre la tuberosidad mayor del estómago, está sujeta al diafragma por el ligamento triangular izquierdo.
El hígado está cubierto por una cubierta fibrosa, la cápsula de Glisson, membrana delgada y transparente.
El peritoneo que lo cubre, además de los medios de fijación forma el ligamento gastrohepático o epiplon menor.
Vasos
Vena porta y sus ramas.
Arteria hepática, rama del tronco celíaco.
Vía biliar extrahepática
Conducto hepático
Nace en el hilio, de la convergencia biliar superior por la unión de los dos hepáticos, derecho e izquierdo; recorre el epiplon gastrohepático por delante y a la derecha de la vena porta; mide 5mm de diámetro y 3 cm de largo, término medio.
Vesícula biliar
Receptáculo membranoso y piriforme, puede llegar a medir hasta 10 o más cm de largo, puede contener por distensión hasta 200 cc de bilis.
Conducto cístico
Tortuoso y fino de aproximadamente 30 mm de largo.
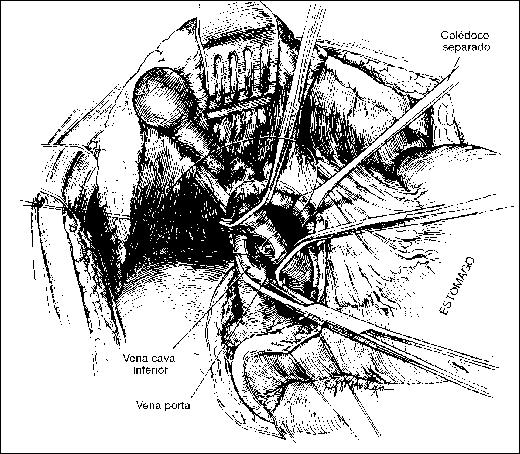
Colédoco
Supraduodenal, retroduodenal, pancreático e intraparietal. Largo: 6 a 8 cm, diámetro: 6 a 10 mm, desemboca en la ampolla de Vater en la segunda porción del duodeno.
SEMIOLOGIA DEL HIGADO Y VIAS BILIARES
Edad
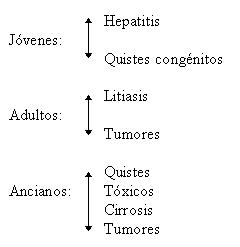
Sexo: Litiasis y discinesias, predominántemente femenino
MOTIVO DE CONSULTA

Determinar fecha de comienzo de los síntomas y duración.
Determinar forma de comienzo, brusca o lenta.
Sitio de dolor y mayor intensidad.
Hora del dolor: diurno, nocturno, Relación con la ingesta, sobre todo con grasas Irradiación: Al hombro homolateral, irradiación en tirante, etc. Posiciones antiálgicas
Náuseas: productivas o improductivas
Vómitos: Acto reflejo por el que se elimina el contenido gástrico, activa y violéntamente por la boca.
Biliosos, alimenticios, porraceos, hematemesis, ácidos, acuosos.
Coluria
Acolia
Prurito
Fiebre:
Colecistitis
Colangitis
Hepatitis
Distensión postprandial
Eructos
Pesadez
Rubicundez
Cefaleas
Intolerancia a colecistokinéticos
Astenia
Anorexia
ANTECEDENTES DE LA ENFERMEDAD ACTUAL
Averiguar: fecha de iniciación de los síntomas, si hubo cuadros anteriores similares, Relación con la ingesta de comidas, contactos con hepatíticos, inyectables, tóxicos (pintores, plomo, TNT, mercurio, arsénico)
ANTECEDENTES PERSONALES FISIOLOGICOS
Higiene, vivienda, antecedentes profesionales (enfermeros, médicos), tóxicos, convivencia en grupos, hábitos alimenticios, alcohol, berro (fasciola hepática), anticonceptivos orales, cloacas, agua corriente, agua de pozo, etc.
ANTECEDENTES PERSONALES PATOLOGICOS
Contacto con hepatitis, inyectables, sueros, transfusiones, hidatidosis, «diátesis urática», amibiasis, esquistozomiasis, aflatoxina (aspérgilus flavus)
ANTECEDENTES QUIRURGICOS
Operaciones sobre el aparato digestivo y vías biliares, vagotomías, etc.
ANTECEDENTES HEREDITARIOS
Litiasis biliar por trastornos metabólicos de lípidos y de pigmentos. Carcinoma de hígado y vías biliares, quistes congénitos de vías biliares como precursores de carcinoma de vías biliares.
Enfermedad de Gilbert: Hiperbilirrubinemia crónica ligera, menor de 3 mg %
Criggler Najjar: Gran ictericia por deficit de glucuronil transferasa, el tipo II es más benigno, disminuye la ictericia al administrar fenobarbital.
Dubin Johnson: aumento de la bilirrubina directa, ictericia intermitente, trastorno de la excreción por parte del hepatocito de aniones orgánicos, entre ellos bilirrubina.
Síndrome de Rotor: Semejante al Dubin Johnson, sin pigmentos en los hepatocitos
Colostasis intrahepática familiar recurrente benigna, enfermedad de Summerskille: Episodios de 3 o 4 meses, con anorexia, pérdida de peso, fosfatasa alcalina elevada, bilirrubina directa elevada, transaminasas elevadas.
EXAMEN FISICO
INSPECCION
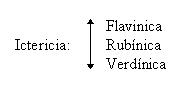
Ictericia;
flavínica: B.D. normal, B.I. elevada
Verdínica: B.D. elevada, B.I. normal
Rubínica: B.D. Normal o elevada, B.I. elevada
Ictericia con tonalidad bronce o negro, en algunas formas crónicas donde existe bilirrubina que impregna los tejidos y pigmento melánico por la irritación prolongada.
Ver conjuntivas y lugares de presión, en la palmas de las manos, la región tenar.
Telangiectasias, rubíes, circulación colateral
Retracción palmar de Dupuytren
Eritema palmar: Por dilatacion vascular, predominante en región tenar e hipotenar
Edemas, ascitis, vientre batraciforme o en obus.
Tumoración en H.D., hepatomegalia.
Asimetría en caso de quistes hidatídicos hepáticos o metástasis o producida por hidropesía vesicular
Vello pubiano de distribución ginecoide, atrofia genital en el hombre, signos de rascado por prurito, estrías, ginecomastia, equímosis, gingivorragias, epistaxis
Flapping tremor en la insuficiencia hepática.
PALPACION
Se comienza en fosa ilíaca derecha y se termina en hipocondrio derecho Manos cálidas
Se efectúa primero palpación superficial, se detectan hepatomegalias, hiperestesias, cambios en el tono muscular.
Luego se realiza la palpación profunda:
I Borde hepático:
- cortante o romo
- nodular o liso, mov. respiratorios
- consitencia, dolor provocado, dolorabilidad, tamaño
II Vesícula biliar
- Aumentos de tamaño y sus desplazamientos, signo del badajo de campana, Ley de Curvoisier Terrier
- puntos dolorosos
III Zonas dolorosas de las vías biliares, puntos.
I Palpación del hígado: Normal, hasta 1 cm por debajo del reborde costal, paciente en decúbito dorsal, con o sin almohada debajo de las rodillas, cabeza ligeramente elevada con una almohada, medico a la derecha, manos tibias
Palpación superficial, Método de Gilbert: para hígados duros y de tamaño aumentado: Manos en ángulo de 45º, la derecha paralela y por fuera del recto anterior del abdomen, con las puntas de los dedos hacia arriba.
Palpación profunda:
Método de Mathieu o del enganche. Método de Chauffard: Del peloteo, mano izquierda en región costomuscular, mano derecha percibe el borde.
Palpación de Sir William Osler: Con las puntas de los dedos dirigidos a la axila izquierda
Método de Glenard: Mano izquierda en la región lumbar derecha del paciente, con la derecha deprime el abdomen, llevando las vísceras abdominales hacia el compartimiento superior. Con el pulgar izquierdo deprime el flanco derecho por debajo del reborde costal. Palpa el hígado en inspiración con el pulgar deslizándose de arriba a abajo y de fuera adentro.
Método de Brugsch: pone la mano izquierda hacia arriba y el pulgar izquierdo hacia adentro, palpa por enganche con la mano derecha.
Palpación por empuje: signo del témpano, en la ascitis.
La palpación permite delimitar el borde hepático, determinar si es cortante o romo, regular o irregular.
Deteminar consistencia: duro, blando, renitente.
Determinar superficie: lisa o nodular y a su vez si es micro o macro nodular, si los nódulos son únicos o múltiples.
Determinar sensibilidad.
II – Palpación de la vesícula biliar
Punto cístico: doloroso, en la unión del reborde costal derecho y borde externo del recto anterior del abdomen.
Signo de Murphy: Interrupción de la inspiración por aparición de dolor brusco a la palpación del punto cístico. Maniobra de Murphy: Paciente sentado en la cama, médico sentado detrás de este y a su derecha; levanta sus brazos y el examinador pasa los suyos poniendo las manos en el punto cístico. Hace una inspiración y al profundizar nuestros dedos se detiene la inspiración.
Maniobra de Pron: Colocados ambos pulgares por debajo del arco costal derecho, en el punto cístico, al hacer la inspiración, se corta por dolor.
Maniobra de Chiray: Paciente. en decúbito lateral izquierdo, con los muslos flexionados sobre la pelvis. El examinador situado detrás del mismo hunde la mano derecha debajo del reborde costal derecho, se provoca dolor a la inspiración.
Maniobra de Moynihan: Paciente. en decúbito supino, examinador a la derecha, se explora con el pulgar, dolor a la inspiración.
III.-Zonas dolorosas de las vías biliares.
Puntos
Punto cístico: doloroso, en la unión del reborde costal derecho y borde externo del recto anterior del abdomen.
Zonas hiperestésicas y dolorosas de Head
Corresponden en región frontal y dorsal a areas de distinta sensibilidad que se distribuyen desde la columna dorsal o desde el epigastrio. Corresponden a patología vesicular.
Zona pancreático-coledociana de Chauffard
Angulo correspondiente al interno, creado por la bisectriz de un ángulo formado por la línea media en su unión a nivel de ombligo con una transversal. Corresponde a procesos dolorosos de la cabeza del páncreas y litiasis coledociana.
Punto de Preioni
A 2 dedos sobre el ombligo, algo a su izquierda, constante en procesos agudos pancreáticos.
PERCUSION
Se realiza desde torax, se comienza en 2º o 3er espacio intercostal, en 5º espacio comienza submatidez y en el 6º, la matidez. Los abscesos subfrénicos y los quistes hidatídicos aumentan la matidez hacia arriba, se percute siguiendo la línea hemiclavicular y laterales. El neumotorax o el enfisema descienden el límite superior percutorio.
Percusión de ascitis:
En los flancos y fosas ilíacas, en forma radiada, con centro en ombligo, diferenciar en hipogastrio con vejiga retencionista, mioma y quiste de ovario.
Maniobra de percusión y palpación combinada en ascitis: para detectar onda líquida, se coloca una mano en la línea media, con otra se percute en el flanco derecho y el ayudante percibe onda líquida en el otro flanco cuando hay ascitis.
Percusión de bazo: en posición de Shuster, decúbito lateral derecho, algo inclinado en sentido dorsal, se percute suavemente siguiendo las costillas o los espacios intercostales, el eje mayor corresponde aproximadamente. a la 11a costilla.
AUSCULTACION
Soplos arteriales: aneurismas de la hepática.
Soplos venosos: por hipertensión portal, síndrome de Crouvellier Baumgarten. Frotes por abscesos o por despulimientos después de biopsia hepática.
MISCELANEAS Espacio Semilunar de Traube
Forma de casquete o semiluna.
Parte anterior izquierda de la base del tórax: Sonoridad timpánica aguda de estómago vacío, ausencia de murmullo vesicular y vibraciones vocales.
Límite inferior el reborde costal, límite superior y externo el reborde de la tuberosidad mayor.
Triángulo de Labbe
Corresponde a la parte inferior de la cara anterior del estómago. Borde externo es el reborde costal, borde interno corresponde al hígado, borde inferior es la curvatura mayor gástrica.
PRACTICAS COMPLEMENTARIAS
PRUEBAS DE LABORATORIO
Eritrosedimentación acelerada
Glucemia
Uremia: falla hepato-renal
Creatinina
Colesterol: Elevado en las obstrucciones, baja en las insuficiencias hepáticas, descienden antes los ésteres
Fosfatasa alcalina, TGP TGO, Gamma glutamil transpeptidasa, 5 nucleotidasa, Leucilaminopeptidasa, Bilirrubinemia
Orina completa: pigmentos y sales biliares
Proteinograma por electroforesis. Albúmina baja en la falla hepática.
Tiempo de protrombina, Tiempo de hemorragia y coagulación
Estercobilina aumentada en las hemólisis.
Urobilinuria aumentada en las hemólisis (por mayor producción de bilirrubina), también cuando hay un tránsito intestinal prolongado y en la invasión bacteriana del intestino delgado.
Urobilinuria disminuida, cuando hay menos pasaje de bilirrubina al intestino (colestasis intra o extra hepática). También un descenso de la urobilinuria se puede producir en caso de tránsito intestinal acelerado.
En las hepatitis aumenta al principio, luego disminuye pues se produce menos bilirrubina y aumenta al final.
Alfa Fetoproteina muy elevada en los hepatomas: VN < 10 ng/cm3, en hepatomas > 300 ng/cm3.
Ante una hepatitis probablemente B se debe investigar el antígeno de superficie: HBSAg y el anticuerpo anticore, HBCAc(central). Al HBS se lo conoce también como antígeno australiano. En la hepatitis B activa, es positivo el anticuerpo contra el antígeno «e» de la hepatitis B.
Actualmente se investigan también anticuerpos específicos de la hepatitis A(IGM e IGG), de las hepatitis C,D,E, anticuerpos de la Hepatitis por virus de Epstein y Bar (tempranos y tardíos) y de la Hepatitis por Citomegalovirus
Pruebas funcionales:
Test de Bromosulfonftaleina, VN Retención < 5% a los 40 minutos
Test de Caroli: Que valora la rapidez de eliminación de bromosulfonftaleina por la vía biliar, mediante sonda duodenal, normalmente comienza a eliminarse a los 20 minutos de una inyección EV. En las hepatitis se acorta, en las obstrucciones de la vía biliar se alarga.
Prueba de la galactosa: Se administran 40 gs de galactosa oral en ayunas en 400 ml de agua, se recoge orina por 4 hs, la eliminación normal es menor de 3 gs pues el hígado normal lo convierte en glucosa
Sondeo duodenal: Prueba de Meltzer Lyon y Tiempos de Varela Fuentes. Este es un dato histórico, ya se ha dejado de hacer, tenía resultados equívocos, no siempre objetivables.
Sonda semirrígida de Camus o de Einhorn, provista de un extremo visible a los Rx.
Se coloca en 2a porción de duodeno. Obtención al aspirar con la jeringa, de un líquido transparente, algo viscoso, de color y aspecto parecido al aceite de oliva. Se recogen unos ml para el análisis (Bilis A). A continuación se instilan 50 ml de sulfato de magnesio al 33 %, que cierra el píloro, relaja el Oddi y estimula la contracción vesicular, Se aspira nuevamente el líquido con la misma jeringa. Después de 5 a 10 minutos, de manera brusca comienza a fluir un líquido transparente, de color pardo oscuro mucho más pigmentado que la bilis anterior, esta es la bilis B , de la que se expulsan 20 a 50 ml.
Después fluye de sonda un líquido amarillo pálido mezclado con líquido gástrico, que lo enturbia, bilis C. En bilis A y B se realizan estudios bioquímicos microscópicos y bacterianos.
DIAGNOSTICO POR IMAGENES
Rx. directa de abdomen, de escaso valor, solo para imágenes cálcicas; signo de Simón en colecistitis gangrenosas.
Imágenes de asas intestinales dilatadas en el ileo biliar, que es un ileo mecánico u obstructivo producido por el pasaje de un cálculo a intestino delgado por una fístula colecisto yeyunal, o colecisto-duodenal.
Colecistografía oral: No hacer en pacientes con hiperbilirrubinemia, eritrosedimentación acelerada, cuadros agudos o enzimas hepáticas elevadas. Si da vesícula excluida, hacer otra placa directa a las 24 hs, casi no se utiliza este estudio actualmente, solo encuentra utilidad en servicios especializados que realizan evacuación percutánea de la vesícula biliar en pacientes de alto riesgo y para su control ulterior.
Colangiografía E.V.: en vesículas excluidas a los Rx por el método oral, aún en pacientes con leve elevación enzimática o con hiperbilirrubinemia menor de 2 mg%. No se hace actualmente, pues no existe el medio de contraste en el mercado. Por otra parte era un estudio de resultados aleatorios, con dificil visualización de la vía biliar extrahepática.
Ecografía: Actualmente es el primer estudio que se pide pues no está limitado por la elevación enzimática, bilirubinemia o cuadro agudo.
T.A.C.: Es un método de alta resolución más costoso; detecta aún pequeños tumores pediculares o lesiones intraparenquimatosas.
R.M.N.: Más costoso que el anterior, pero aun de mayor resolución, actualmente ha incrementado sus indicaciones para la visualización nítida de lesiones intraductales y parenquimatosas, llegándose hasta tal punto en su aplicación, que en centros especializados de cirugía hepatobiliar se considera como innecesario la instrumentación de la vía biliar por endoscopía, salvo que ya se haya demostrado litiasis coledociana.
Colangiopancreatografía endoscópica retrógrada: Ideal para aclarar obstrucciones pediculares o hiliares, sin vía biliar dilatada, también cuando se estudian obstrucciones biliares en pacientes con coagulopatías o en ascitis graves. Como es útil para evaluar el duodeno y la zona ampular, facilita el diagnóstico de tumores periampulares y pancreatitis crónica, permite además biopsias y en casos especiales, citología por cepillado.
Método invasivo: es la colangiografía trans-parietohepáticaC.T.P.H., en obstrucciones, preferiblemente después de una ecografía que de indicios de una vía biliar dilatada, permite además la degravitación de la vía biliar e incluso la colocación de catéteres. Método de Molnar.
La C.T.P.H fue el inicio para llegar a la descompresión de la vía biliar intra y extrahepática, mediante catéteres (stents), o prótesis expansibles que se usan en la actualidad por vía percutanea o por vía endoscópica.
La C.T.P.H. requiere protrombina con valores superiores al 70 % o sinó debe prepararse al paciente mediante vitamina K por vía parenteral.
Gammagrafía de hígado y vías biliares: con imino diacético (macromolécula) HIDA y 99Tc, en 15′, 20′, 40′ y hasta en 20 Hs, en casos de pasaje retardado.
También se puede hacer con 189Au coloidal, bromosulfaleina marcada con 131I, o con polivinilpirrolidona marcada con 113In, o verde de indocianina marcado con 113In.
Arteriografía selectiva con catéter de Seldinger, permite en ocasiones realizar diagnóstico diferencial entre quistes y tumores. También tiene su indicación para definir la anatomía vascular intrahepática, previo a una cirugía de resección y para valorar el compromiso vascular por tumores primarios y secundarios.
Laparoscopía, biopsia percutánea, biopsia laparoscópica y actualmente videolaparoscópica.
Terapéutica médica del cuadro de colecistitis aguda: o se opera en pocas horas o días, o se espera 60 días.
Terapéutica Quirúrgica
En algunos cuadros agudos con bloqueo de la convergencia biliar inferior, solo colecistostomía.
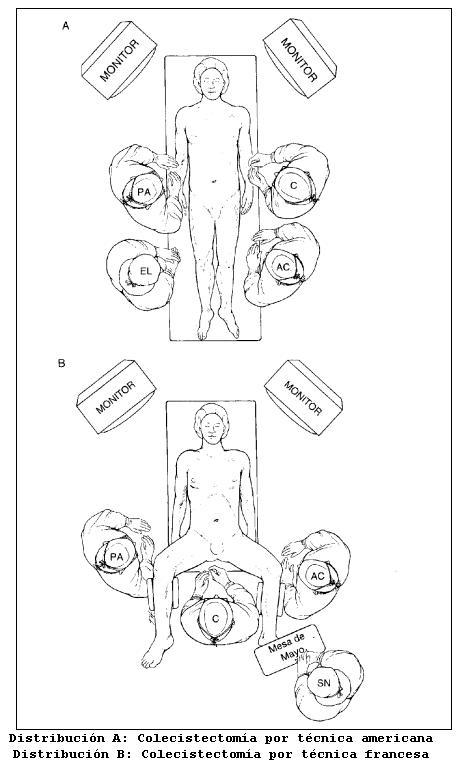
Lo ideal es la colecistectomía, se realiza la colangiografía intraoperatoria. Actualmente existe la opción de la colecistectomía videolaparoscópica. Si hay litiasis coledociana se realiza coledocotomía, litoextracción y cierre de la coledocotomía sobre tubo de Kehr.
Esta operación ya se hace por vía laparoscópica. Si hay litiasis papilar se realiza papilotomía transduodenal, pero actualmente existe la opción de la papilotomía endoscópica.
Si hay vía biliar dilatada y estenosis orgánica, o funcional marcada, en pacientes añosos, se realiza colédoco-duodeno-anastomosis. En las litiasis vesiculares colesterínicas se intenta realizar su destrucción con ácidos biliares como el quenodesoxicólico. También se intenta tratamiento con ondas ultrasónicas extracorporeas.
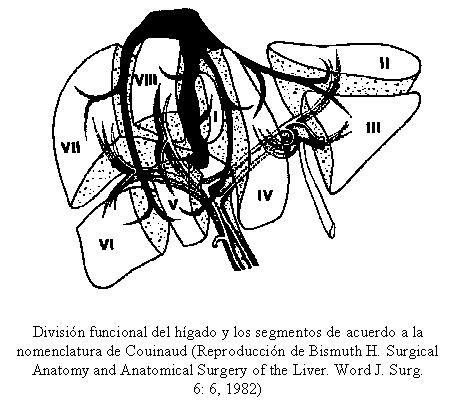
En los tumores hepáticos se realizan hepatectomías derechas o izquierdas simples o ampliadas.
En los tumores de la vía biliar, resecciones hepáticas que comprenden lóbulos, sectores o segmentos, asociadas a resecciones parciales, segmentarias, de la vía biliar y anastomosis con yeyuno, calibrados o no con tutores multiperforados.
En los tumores irresecables de la vía biliar principal o de la vesícula biliar, intubación trans-tumoral trans hepática, realizadas por vía laparotómica, percutánea o o endoscópica.
Actualización
En la profilaxis de la hepatitis B, se realiza la vacunación con tres dosis a los integrantes de los grupos expuestos, entre los que s se halla el personal de salud.
En el tratamiento de las hepatitis virales tipo C crónicas, se estableció que aquellos que respondieron al primer curso de terapia con Interferón, responderían a un segundo curso. Pero la mayoría de los pacientes están expuestos a una reactivación finalizado aquel, habiéndose observado que los cambios mutacionales en el genoma del HCV, que lleva al desarrollo de quasispecies, puede ser la causa de la recidiva.
La dosis utilizada puede tan solo suprimir la replicación viral, pero al final del tratamiento el virus podría permanecer en el hígado o en sus reservorios extrahepáticos.
El interferón alfa se utiliza en dosis que varían de 1.500.000 Unidades a 10.000.000 de Unidades en períodos de 3 meses en dosis progresivas. El Consensus lnterferón es un nuevo Interferón tipo I, que permite la administración de dosis más altas, de 3 a 15 millones de unidades 3 veces por semana durante 6 meses , con una respuesta durable, con negatividad persistente del HCV RNA en suero de los pacientes.
Colangitis o Colangiopatía autoinmune. Esta entidad clínica pertenece al grupo de las enfermedades hepáticas colestáticas de probable origen autoinmune, comparte características clínicas con la cirrosis biliar primaria, pero presenta anticuerpos antinucleares positivos, antimitocondriales negativos. La colangiopatía autoinmune responde en mayor medida a los inmunomoduladores y al ácido ursodesoxicólico que la CBP.
TRAUMATISMOS HEPATICOS
El hígado pese a estar protegido por las costillas, sufre en muchas ocasiones los traumatismos directos o por contragolpe.
Frecuencia: es la víscera que más frecuentemente se ve lesionada después del bazo. Etiología
Traumatismos cerrados: producidos por accidentes de automóviles, agresiones con objetos romos, coz de caballo.
Traumatismos abiertos: Producidos por armas blancas, vidrios, chapas, o por armas de fuego.
Clasificación anatomopatológica
Ruptura con desgarro
Ruptura subcapsular
Ruptura central
Estallido:producidas generalmente por proyectiles de alta velocidad.
MANIFESTACIONES CLINICAS:
El derrame de sangre en la cavidad peritoneal produce síntomas de:
Shock hipovolémico.
- Hipotensión
- Taquicardia
- PVC baja
- Débito urinario disminuido
Iritación peritoneal
Laboratorio
- Leucocitosis, Descenso del Hematocrito.
- Hiperbilirrubinemia ligera
Radiología
- Fracturas costales
- Hepatomegalia
- Diafragma elevado
- Banda opaca, ancha en parietocólico derecho
Ecografía: Líquido en cavidad
Centellografía: Hematoma central
TRATAMIENTO
Laparotomía: detener la hemorragia
Sacar el tejido hepático desvitalizado
Tratar el shock y las lesiones torácicas previamente a la operación
Dejar drenajes en cavidad
Ante una hemorragia arterial o venosa se prefiere realizar una ligadura directa en lugar de puntos de colchonero pues estos producen necrosis adicional de tejidos y el riesgo de hemobilia o abscedación.
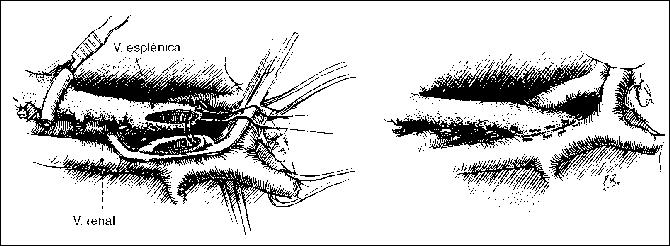
LESIONES DE LAS SUPRAHEPATICAS
Producen rapidamente shock, debe buscarse mediante una amplia exposición el sitio de sangrado, comprimir con compresas hasta poder hacer una sutura adecuada de la o las venas lesionadas, debe hacerse en estos casos un muy rápido aporte de volumen.
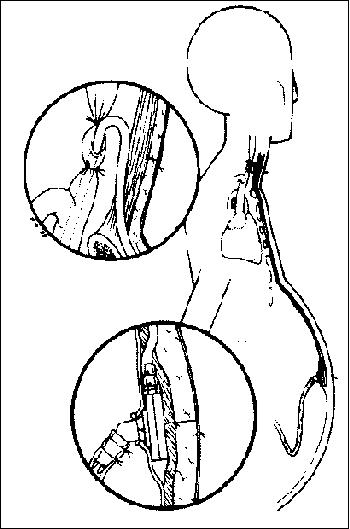
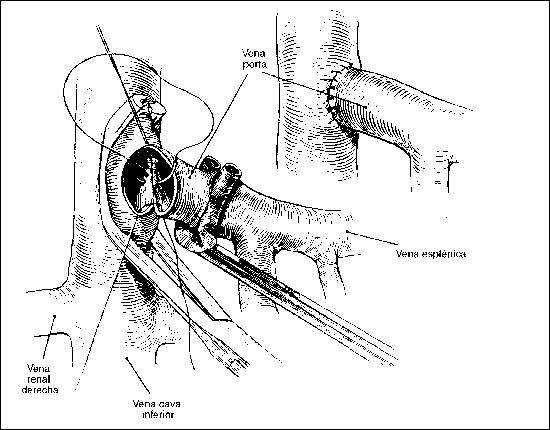
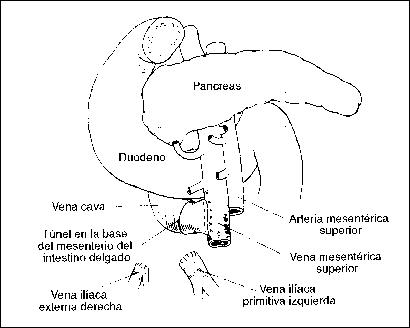
LESIONES DE LA VENA PORTA
Requieren de sutura directa, prótesis, o cortocircuitos con el sistema de la vena cava. Complicaciones: Sepsis, Hemorragias secundarias, abscesos
RUPTURA ESPONTANEA DEL HIGADO
Etiología: Toxemia del embarazo, tumores, quistes, fiebre tifoidea, arteritis obliterante. La ruptura del hígado en recién nacidos está relacionada a sobrepeso y a partos difíciles
HEMOBILIA
Se produce por comunicación anormal entre un vaso sanguíneo y el árbol biliar
Etiología: Traumatismo u operación
Síntomas:
- Dolor cólico
- Hemorragia digestiva
- Ictericia intermitente
Diagnóstico por imágenes:
- Ecografía, centellografía
- Arteriografía
Tratamiento:
- Resección de la Lesión
- Ligadura de la rama
- Segmentectomía