En palabras de Grawitz, es la reacción de tejidos irritados y dañados, los cuales conservan vitalidad.
Burdon-Sanderson lo define como el proceso que es la sucesión de cambios que ocurren en el tejido vivo cuando es injuriado, cuando la injuria no es de tal grado, que desde el comienzo destruye su estructura y vitalidad.
Menkin lo define como: El complejo vascular, linfático y la reacción de tejido local, en los animales superiores, por la presencia de micro-organismos o irritantes no viables.
Ebert propone: Inflamación es un proceso el cual comienza siguiendo a una injuria subletal al tejido y termina con la completa curación.
Lo importante es dar la idea que inflamación es un proceso y no un estado, que el area inflamada desarrolla distintos cambios, se ha probado como posible para su estudio desarrollar modelos animales en los que se pueden observar los cambios sucesivos macro y microscópicos.
Podemos intentar por ahora definirla, como, un proceso que sucede en todo el tejido mesenquimático vascularizado, ante la acción de una noxa física, química, o biológica, desencadenando sucesivamente fenómenos vasculares, humorales, exudativos, celulares, reparativos y proliferativos, que tienden a limitar la acción de la noxa.
Los epitelios conforman una barrera ante la agresión de la noxa, si bien no en el contexto del fenómeno inflamación.
Los epitelios estratificados y transicionales, son un factor de detención de la acción de los agentes agresores, mientras que los epitelios cilíndricos actuan por la secreción mucinosa y por su movilización, y por la acción ciliar, por el mecanismo catarral. Otras acciones de los epitelios de las mucosas, son la liberación de enzimas proteolíticas e inmunoglobulinas producidas por los linfocitos B secretorios y plasmocitos del corion, sobre todo IgA
Consideraciones históricas
La inflamación ha sido estudiada desde los más tempranos tiempos. El pus es descripto en los papiros egipcios del segundo milenio a.de C. y fue relacionado con el demonio de la enfermedad, los abscesos y úlceras fueron reconocidos.
Hipocrates y su escuela hicieron una buena observación en inflamación de las partes externas y su termino erisipela, literalmente, enrojecimiento de la piel, ha durado hasta estos días como la descripción de cierta infección de la piel caracterizada por la extensión de un area roja.
El término edema, también originado en la antigua Grecia persiste con su mismo significado actualmente.
La doctrina de los cuatro signos cardinales de la inflamación, enrojecimiento, tumor en el sentido de bulto (edema), calor y dolor fue enunciada por Celsius, alrededor del 30 a. de C. al 38 d. de C. y a esto Galeno (130-200 d. de C.) que fue la primera persona que escribió extensivamente sobre inflamación, agregó el quinto signo, “functio laesa” y más tarde John Hunter (1728-1793) también llamó la atención sobre la pérdida de la función.
Boerhaave, (1668-1738), holandés, puso enfasis en los cambios de estado de los vasos sanguineos en la inflamación.
Cohnheim (1882) llamó la atención sobre la migración de corpúsculos blancos desde los vasos sanguineos.
Cohnheim compartió con Samuel la visión de que el principal rasgo de la reacción, era un incremento de la permeabilidad de la pared vascular.
Metchnikoff (1845-1916), cientifico ruso que trabajó en Odessa en su juventud y cuyos principales trabajos efectuó en el instituto Pasteur de Paris, enfatizó el papel de la fagocitosis como fenómeno central, igualmente potentes argumentos consideraban que la principal función de protección era debida al factor humoral, avanzando en lo que actualmente se conoce como la inmunología.
REACCIONES GENERALES DEL ORGANISMO ANTE LA ACCION DE UNA NOXA
Fiebre: reacción inespecífica de elevación de la temperatura por sobre los valores fisiológicos, originada por la acción de pirógenos exógenos, virales o bacterianos que actuarían mediando la liberación de pirógenos endógenos (polipéptidos de lisosomas de los neutrófilos y otras células) que actuarían a través de los centros de termorregulación hipotalámicos, asi como también por la producción local de prostaglandinas E1 que por acción sobre centros superiores producirían vasoconstricción, disminución de la pérdida de calor y fiebre.
Leucocitosis: Particularmente en algunas infecciones bacterianas.
Velocidad de sedimentación globular aumentada. Se origina en la densidad proteica del plasma, especialmente alfa, gamma globulinas y fibrinógeno.
Acción hipofisocorticoadrenal. Con secreción aumentada de A.C.T.H. y corticoides, que obrarían inespecificamente como inhibidores de la reacción inflamatoria, bloqueando la exudación de leucocitos, la fagocitosis, disminuyendo la producción de linfocitos y anticuerpos y la fase reparativa de la inflamación.
Observaciones Macroscópicas
Enrojecimiento
Triple reacción
Lewis y cols. analizaron los fenómenos que siguen a variados grados de injuria a la piel humana, describieron lo que fue llamado la triple reacción, el cual consiste al principio en un area central roja embotada, rodeada por un halo rojo brillante, para ser seguida de edema del area roja embotada. Esta reacción puede ser producida por el golpe del ángulo de una regla en el antebrazo o la espalda.
Una linea roja aparece exactamente donde la regla fue aplicada. este area roja embotada es inmediatamente rodeada por un halo rojo brillante, que se estira 2 o 3 cm alrededor, el edema o verdugón entonces aparece a lo largo de la linea del golpe, la cual se torna pálida, el edema aumenta y finalmente hay un verdugón pálido, rodeado por un ancho area roja encendida.
En este simple experimento se producen los signos cardinales de la inflamación, tales como enrojecimiento, edema, calor.
Lewis demostró que diversos estímulos físicos producen la triple respuesta, tales como el calor, frio, electricidad, rayos x, ultravioleta y varios irritantes químicos, como las cantáridas.
Ebbecke propuso corto tiempo antes que Lewis, que las injurias podrían liberar sustancias químicas que causan vasodilatación local.
Lewis y cols. analizaron el problema del enrojecimiento y edema y dedujeron que tras el estimulo producido por el agente físico o químico se producía liberación de sustancias químicas en el tejido injuriado, que dilataban directamente capilares y vénulas, esto explica el area central dilatada y roja, además se estimulaban terminales nerviosas sensitivas, poniendo en acción un reflejo axonal a través del cual las arteriolas por fuera del area injuriada eran dilatadas, por lo tanto el halo rojo encendido por fuera del sitio de injuria se producía.
Lewis atribuyó estas acciones a la histamina o sustancias similares, que son liberadas por las células de los tejidos y que actuarían sobre los pequeños vasos y los terminales nerviosos. Actualmente muchas sustancias de esta naturaleza pueden ser consideradas y no se puede hacer una clara distinción entre su efecto vasodilatador y su capacidad para incrementar la permeabilidad capilar.
La concentración del ion H+ durante el proceso de inflamación se encuentra elevada en el tejido (Schade) y la vasodilatación podría ser producida o mantenida por la acidez elevada.
Calor
cuando la inflamación incrementa el aporte de sangre a través de los vasos dilatados, esto podría explicar el aumento de la temperatura.
Por otra parte se ha comprobado un incremento del metabolismo en el tejido inflamado, estos tejidos consumen más oxígeno.
Dolor
Podría ser producido por sustancias que se liberan en el tejido inflamado tales como 5-hidoxitriptamina y Bradikinina, que estimularían las terminales nerviosas.
La pérdida de la isotonicidad de los fluidos corporales también pueden explicar el dolor,(la alteración del balance de sodio, potasio, calcio e hidrogeniones).
La presión es un factor que produce dolor, esto se comprueba cuando se evacuan fluidos o pus de una lesión, el dolor y la sensibilidad inmediatamente disminuyen.
Edema
Alteración de la permeabilidad capilar
Fluidos que contienen proteinas, conocidos como exudados, se acumulan en los tejidos formando la pápula, después de injurias leves y tumefacción en lesiones más serias, entre las proteinas se encuentra fibrinógeno y depositos de fibrina.
En condiciones normales, solo muy pequeñas cantidades de proteinas pasan al intersticio
Las proteinas que pasan a los tejidos por el incremento de la permeabilidad que se produce durante la inflamación, alteran la presión osmotica en los tejidos y atraen más solutos, aumentando el edema, además se menciona que la presión hidrostática en la microcirculación también está aumentada durante la hiperhemia inflamatoria.
Mediadores químicos que aumentan la permeabilidad
A) Proteasas: Plasmina, Kallikreina
y factor de permeabilidad de las globulinas.
No parecen tener acción directa sobre los vasos, sino a través de la producción de péptidos vasoactivos.
Plasmina es una proteasa que está inactiva como precursor plasminogeno, que se activa por dilución o por extracto de tejidos .
El kallikreinógeno se activa ante la presencia de enzimas.
El factor de permeabilidad de las globulinas es una sustancia que migra con las globulinas alfa o beta y que se acompaña con un factor inhibidor (Pro PF/IPF), es también una proteasa.
B) Polipéptidos: Leukotaxina, Bradikinina y Kallidina
La kalikreina rompe un kininogeno, Kallidinógeno en Kallidina, un peptido vaso activo.
C) Aminas: Histamina y 5-hidroxitriptamina.
Histamina está en los mastocitos, que pueden liberarla sin degranularse, es responsable de la reacción inflamatoria inmediata y podría jugar un rol en la reacción lenta o continua. La enzima productora de histamina es la histidina decarboxilasa.
5-hidroxitriptamina, se almacena en gránulos en las plaquetas, mastocitos y células argentafines, es una sustancia vasoactiva, capaz de producir dolor.
Otras sustancias
Nucleósidos y Nucleótidos
Inosina, adenosina y guanosina, el ácido adenílico y el nucleótido, ácido inosínico, pueden producir reacción de vasodilatación
Hialuronidasa
Pocos minutos después de la agresión a un tejido se visualiza que la matriz amorfa del tejido conectivo cambia de gel a fluido, debido a la acción de la hialuronidasa que depolimeriza los mucopolisacaridos del tejido conectivo, se acumula en los tejidos inflamados y es activada por algunas bacterias tales como estreptococos , estafilococos y el cl. Welchii
Acido láctico, que se debe a la anaerobiosis podría ser suficiente para incrementar la permeabilidad, el acido láctico puede ser también producido por la migración de leucocitos
CRONODINAMIA
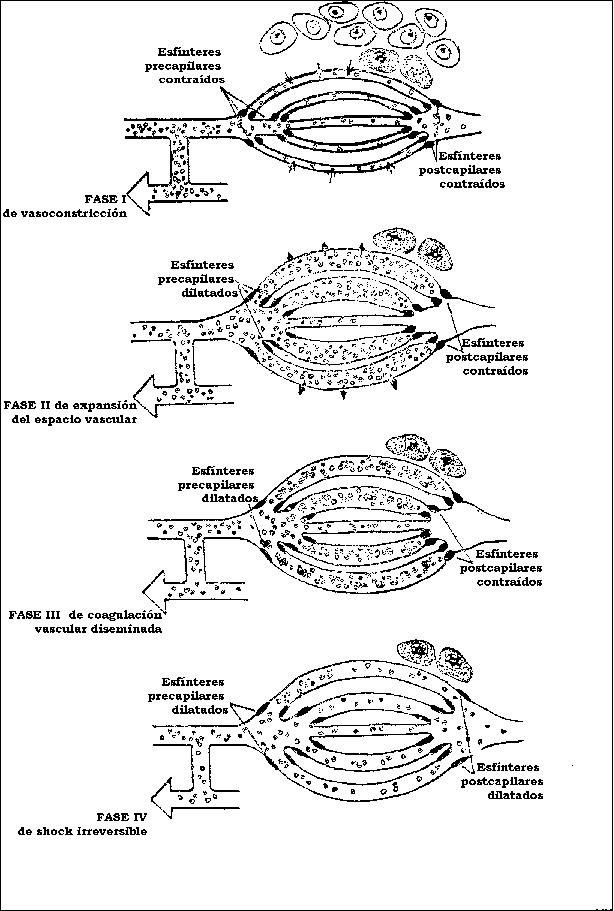
a) FENOMENOS VASCULARES
Se manifiesta inicialmente con una vasodilatación con aflujo de sangre arterial, a continuación breve vasoconstricción transitoria que afecta al lecho capilar con enlentecimiento progresivo de la circulación. Tiene como causa la liberación local de mediadores químicos celulares.
Mediadores celulares
Aminas vasoactivas, sobre todo histamina, liberada de mastocitos, basófilos y plaquetas.
Serotonina, de mastocitos y plaquetas, tambien aumenta la permeabilidad vascular.
También se liberan:
Proteinas catiónicas.
fracciones del complemento C3a y C5a (anafilotoxina). Citocinas* mediadoras primarias (Interleucina 1 (IL1), Factor de necrosis tumoral (TNFa), o bien beta1 o gamma Interferón), la IL1 actuaría sobre el eje hipotalamohipofisosuprarrenal, liberando ACTH y glucocorticoides, e induciría a la síntesis de IL6, que actuaría sobre el hepatocito en la producción de proteinas de la fase aguda como reacción sistémica secundaria.
Acidos grasos provenientes de la degradación de membranas, por acción de la fosfolipasa A, dando origen a la formación de los Leucotrienos.
También se generan prostaglandinas y el tromboxano A2.
Mediadores plasmáticos
Proteasas plasmáticas
Las Kallikreinas produciendo potentes agentes vasodilatadores polipeptídicos como las bradicininas, que además producen dolor y activan la coagulación
El sistema de coagulación y la liberación de fibrinopéptidos activan el quimiotactismo de los polinucleares.
El sistema del complemento
Sistema de componentes proteicos necesario para que los anticuerpos puedan actuar sobre los agentes microbianos.
b) FENOMENOS HUMORALES
Se establece entonces a partir de la acción de los mediadores celulares y plasmáticos, una tumefacción del tejido adyacente, el edema inflamatorio, constituido por una extravasación plasmática aumentada con tenor elevado de fibrinógeno. El edema inflamatorio diluye las toxinas microbianas y aporta anticuerpos de las proteinas plasmáticas.
El fibrinógeno del edema inflamatorio es activado por la trombocinasas de los tejidos y la trombina, originándose la red de fibrina, limitante del foco inflamatorio.
El edema inflamatorio puede originarse en el tejido vascularizado que sufre inflamación o bien ubicarse en cavidades naturales, serosas, o alvéolos pulmonares.
La causa del edema inflamatorio tiene origen en la alteración endotelial, el aumento de la presión hidrostática secundario a la hiperhemia, la disminución de la presión osmótica intravascular como consecuencia de la extravasación proteica y el consecutivo incremento de la presión osmótica en el tejido inflamatorio.
c) FENOMENOS EXUDATIVOS
Se instala la diapédesis leucocitaria, migración de los leucocitos polinucleares neutrófilos a los tejidos, esto se favorece por el quimiotactismo, por acción de los factores C3 y C5 del complemento y posterior pasaje de la membrana basal por depolimerización merced a enzimas lisosómicas leucocitarias.
d) FENOMENOS CELULARES
Originan el denominado granuloma inflamatorio, al principio actua el leucocito polimorfonuclear que libera sustancias liberadoras de histamina, factor quimiotáctico de histiocitos, radicales libres, peróxidos, que favorecen la síntesis de prostaglandina por activación de fosfolipasa, activando además otras enzimas como elastasa, colagenasa, etc.
El monocito de la sangre que se lo identifica como el histiocito en los tejidos con función macrofágica.
e) FENOMENOS REPARATIVOS O DE DETERSION
Los macrófagos se distribuyen en los tejidos mesenquimáticos, poseen un arsenal de mediadores denominados citocinas o monocinas.
También poseen enzimas lisosómicas: Lisozimas, fosfatasas, proteasas, esterasas, lipasas, colagenasas, elastasas y componentes del complemento, prostaglandinas, leucotrienos, factor activador de las plaquetas, radicales libres, (peróxido de hidrógeno, superóxido, radicales oxhidrilo), pirógenos endógenos, interferóna, factores activadores de linfocitos T y B, estimulantes de crecimiento de células mesenquimáticas (Angiogenético).
Las células de este sistema son capaces de ingerir partículas (fagocitosis), conformando una verdadera función depurativa tisular, conservando en el macrófago metabolitos del material digerido.
Los mastocitos serían también derivados del monocito de la médula osea.
Las células monocíticas tienen la función de presentadoras de antígenos a los linfocitos T y B.
Los linfocitos B, responsables de la actividad inmunitaria humoral, dando origen a las inmunoglobulinas y a las células
linfoplasmocitarias.
Los Linfocitos T se diferencian en distintas poblaciones con función específica, son responsables de la inmunidad celular; se diferencian en Linfocitos T helpers, con antígeno de membrana T4, responsables de la inmunidad celular, de favorecer la inmunidad humoral y en ocasiones de favorecer la supresión.
Los linfocitosT4 poseen la capacidad de secretar linfocinas, Interleucina o IL2, interferón alfa y gamma, etc.
Los linfocitos T supresores, expresan un antígeno de membrana T8 y son citolíticos, destructores de células con antígenos no reconocidos, células neoplásicas, injertos, células infectadas por micro-organismos, lo cual corresponde a su función citotóxica.
Esta función citotóxica la cumplen además las células con granulaciones azurófilas, denominadas Natural Killer
f) FENOMENOS PROLIFERATIVOS
Luego de la actividad macrofágica, por digestión enzimática, comienza la proliferación de fibroblastos, que evolucionan a fibrocitos y neovasos, que van aportar nutrientes para el proceso proliferativo o cicatrizal. Esta lesión se denomina en su etapa temprana angiogranuloma, caracterizada por la presencia de vasos, edema, el componente celular y el componente fibrilar colágeno.
FORMAS DE PRESENTACION DE LA INFLAMACION
Serosa
Con relleno de un líquido albuminoso, exudado seroso, de los alvéolos pulmonares, o de las cavidades con revestimiento mesotelial.
Fibrinosa
Mayor cantidad de proteinas plasmáticas, especialmente fibrinógeno, que se transforma en fibrina, forma depósitos friables, elásticos, blanco amarillentos: Serosa pericárdica, pleural, sobre el epitelio laringeo en la difteria.
Purulenta
El exudado fibrinoso es reemplazado progresivamente por leucocitos, que sufren fenómenos involutivos nucleares: picnosis y rexis y degeneración grasa del citoplasma, con muerte de numerosos granulocitos, piocitos, conformando un contenido filante amarillento.
En ocasiones el órgano asiento del exudado purulento, limita dicho proceso mediante una pared angiogranulomatosa, con tejido fibroso en su periferia, lesión denominada absceso, el absceso, lesión delimitada, se opone conceptualmente al flemón, difuso, poco delimitado, constituido por exudado purulento con componente serohemorrágico.
El empiema es la colección purulenta en una cavidad orgánica: vísceras huecas (apendicular, vesicular) o en serosas: pleura, pericardio.
Hemorrágica
Fenómenos exudativos de inflamación aguda, asociados a eritrodiapédesis intensa, por acción de toxinas microbianas (Sepsis por Gramnegativos; Ej.: Lesión hemorrágica con hipocorticismo, Sindrome de Waterhouse-Friederichsen.
Necrosante
Lesión necrótica por acción trombosante generada por anaerobios (clostridios), que liberan potentes toxinas, o por el estáfilococo dorado, afectando folículos pilosebaceos, generando forúnculos o antrax.
La inflamación en la que predominan los fenómenos celulares mononucleares (linfocitaria, histiocitaria y plasmocitaria), corresponden a lo que denominamos inflamación crónica, aunque las virosis se pueden manifestar con exudado mononuclear en etapas clinicamente agudas de la enfermedad.
Las linfocinas son glucoproteinas de bajo peso molecular que intervienen como señales de mediación en una compleja red de comunicaciones intercelulares, que opera regulando el sistema inmunitario. Son también factores de crecimiento de diversas células y especialmente de las células hematopoyéticas. El término linfocina fue introducido por Dumonde en 1969 para describir factores solubles liberados por los linfocitos tras el estímulo producido por un antígeno. Posteriormente fueron introducidos los términos monocina y citocina, para denotar que tanto los monocitos como otras células no linfoideas pueden ser el origen de algunos de estos factores.
| RELACION DE LINFOCINAS LINFOCINA |
ACRONIMO |
| Interleucina-1 (alfa y ß) | IL-1 alfa y ß |
| Interleucina-2 | IL-2 |
| Interleucina-3 | IL-3 |
| Interleucina-4 | IL-4 |
| Interleucina-5 | IL-5 |
| Interleucina-6 | IL-6 |
| Interleucina-7 | IL-7 |
| Tumor necrosis factor-alfa | TNF-alfa |
| Tumor necrosis factor-ß | TNF-ß |
| Interferón-alfa | IFN-alfa |
| Interferón-ß | IFN-ß |
| Interferón-gamma | IFN-gamma |
| Factor estimulante de colonias de granulocitos y macrófagos | GN-CSF |
| Factor estimulante de colonias de granulocitos | G-CSF |
| Factor estimulante de colonias de macrófagos | M-CSF |