INFECCIONES EN CIRUGÍA
DESEQUILIBRIOS HIDROELECTROLÍTICOS
MANEJO INICIAL DEL POLITRAUMATIZADO
RESPUESTA A LA LESIÓN
CANALIZACIONES VENOSAS
Peritonitis
SINDROME COMPARTIMENTAL ABDOMINAL (Presentación)
TRAUMATISMOS ACCIDENTALES Y QUIRURGICOS
CONCEPTOS Y VARIEDADES
Una incisión del cirujano, una fractura de los huesos del cráneo por caída sobre el suelo, una quemadura por llama, las lesiones en las manos de un radiólogo mal protegido, y una causticación del esófago por ingestión de lejía, son traumatismos.
En todas ellas se trata de lesiones de estructuras histológicas producidas por la acción, casi siempre de un agente portador de energía, con capacidad lesional, que se convierte en el agente traumático.
De acuerdo con la cualidad de la energía se distinguen las siguientes variedades:
1. Energía fisica: a) Mecánica. b) Térmica. c) Eléctrica. d) Radiactiva.
2. Energía química.
La incisión del cirujano es un traumatismo producido por un agente mecánico, como lo es, también, la fractura de los huesos del cráneo; la quemadura por llama es un traumatismo producido por agente térmico; las lesiones en las manos de un radiólogo mal protegido, son traumatismos producidos por un agente radiactivo; mientras que la causticación del esófago, es un traumatismo producido por un agente químico.
La energía traumática produce un foco de lesiones, denominado foco traumático, en el cual se encuentran fenómenos de desvitalización y necrosis celular, con roturas de vasos y hemorragias, y solución de continuidad histológica más o menos importante.
Cuando el foco traumático se produce en la zona de impacto de la energía, el traumatismo lo es por acción directa; así sucede en una fractura de rótula por caída sobre la rodilla, o en el hundimiento del hueso malar por un golpe violento sobre el pó-
mulo. Por el contrario, en un traumatismo por acción indirecta, el foco traumático se encuentra a distancia de la zona de acción energética; así acontece en un desgarro del parénquima hepático, por caída sobre ambos talones (lesión por contragolpe), en una fractura supracondílea del húmero, por caída sobre la mano extendida, y en una fractura de la rótula por brusca contracción del músculo cuádriceps.
El foco traumático induce una respuesta orgánica local, que no es otra cosa que un proceso inflamatorio. A su vez, a partir del foco traumático inflamado se activa una respuesta orgánica general, inespecífica pero sistemática, que puede entenderse
como respuesta biológica a la agresión.
También el foco traumático, de acuerdo con su gravedad y su localización, es responsable de una impotencia funcional, en la que se incluyen desde la imposibilidad de caminar, en un sujeto con fractura de la extremidad inferior, hasta la pérdida del
conocimiento en un traumatismo craneoencefálico.
Cuando un paciente sufre de modo casi simultáneo la acción de varios agentes traumáticos, que producen distintos focos lesionales, estamos en presencia de un politraumatizado, situación habitual, por ejemplo, en los accidentes de circulación o en
los niños apaleados.
En estos pacientes, las lesiones consideradas individualmente (traumatismo craneoencefálico más rotura de bazo y fractura de fémur) no sólo suman sus efectos lesivos, sino que se potencian mutuamente.
¿Qué diferencias existen entre el traumatismo provocado por la acción del cirujano y los que no lo son? Compartiendo todas las características del análisis hasta ahora realizado agente traumático portador de energía, foco traumático, respuesta local inflamatoria, y respuesta general, la diferencia se encuentra en el hecho de que el traumatismo quirúrgico se realiza con una finalidad curativa o paliativa. Esto justifica la distinción de dos grandes grupos de traumatismos: 1) Traumatismos quirúrgicos. 2) Traumatismos accidentales.
Como la cirugía es esencialmente agresiva, es por lo que el cirujano, consciente de esta capacidad lesional, trata siempre de disminuir la extensión y gravedad del foco traumático operatorio (de donde la recomendación por el gran cirujano norteamericano Halsted [1852-1922] de la «técnica atraumática», como desideratum quirúrgico), así como las consecuencias locales y generales de la agresión.
La acción traumática casi siempre se aplica, en primera instancia, sobre la cubierta cutánea y los tejidos blandos subcutáneos (traumatismos de las partes blandas). En ocasiones, el traumatismo se produce directamente en un órgano interno a través
de un orificio natural: perforaciones del recto por empalamiento, o roturas del esófago durante un examen endoscópico.
La intensidad y características morfológicas de la lesión de los tejidos dependen de: a) La cualidad de la energía del agente traumático, (mecánica, térmica, radiactiva, o química), su intensidad (mensurable en la energía mecánica, y en grados en la energía térmica), y el tiempo de acción sobre el organismo.
b) La dirección en que se aplica la energía.
c) La resistencia específica de los distintos tejidos, a los diferentes tipos de energía.
d) La morfología del agente portador de energía.
En todo caso, el agente traumático, aunque actúa casi siempre en primera instancia sobre la cubierta cutánea, no agota su energía a este nivel, sino que puede ejercer su acción lesiva sobre estructuras subcutáneas, en sentido amplio (lesiones internas).
La solución de continuidad de la cubierta cutánea también justifica, la separación
de los traumatismos en dos grandes apartados:
1) Traumatismos cerrados. 2) Traumatismos abiertos.
Se estiman como traumatismos cerrados, aquellos en los que no se ha producido, por la acción traumática, solución de continuidad en la cubierta cutánea. Pero, bajo esta cubierta que mantiene su continuidad, pueden encontrarse graves lesiones profundas. Estos traumatismos corresponden al concepto clásico de la contusión.
Por el contrario, son traumatismos abiertos, aquellos en los que se ha producido una solución de continuidad en la superficie cutánea, de modo independiente a la cuantía de las lesiones profundas. Estos traumatismos corresponden al concepto clásico de herida.
Esta distinción no tiene, por sí misma, valor pronóstico. Una contusión sobre las caras laterales de las últimas costillas izquierdas, llamadas «esplénicas» por su relación topográfica con el bazo, puede dejar como huella una coloración sanguínea bajo la piel conocida como equimosis o extravasación de sangre en el tejido celular subcutáneo y, sin embargo, haber producido la rotura del bazo con hemorragia intraperitoneal (hemoperitoneo), con el consecuente desarrollo de una grave insuficiencia circulatoria periférica que termina en un estado de shock.
Una herida puede ser muy aparatosa por su extensión y no obstante, no afectar en profundidad a ninguna estructura importante.
Por otro lado, la solución de continuidad en la cubierta cutánea es una puerta abierta al desarrollo de una infección, entendida como proceso de colonización y penetración bacteriana, ya que facilita, la entrada masiva de gérmenes patógenos en el interior de los tejidos (contaminación).
En la clara posibilidad de la complicación infecciosa, radica la importancia de la distinción entre contusión y herida. Además, la puerta abierta que es la herida también puede facilitar la pérdida de sangre y líquido extracelular: esto sucede, de modo manifiesto, en las quemaduras extensas, en las cuales la amplia pérdida de la cubierta cutánea es causa, al mismo tiempo, del gravísimo problema de las complicaciones infecciosas, y también lo es de la exudación de una importante cantidad de líquido extracelular.
No obstante, en los traumatismos que afectan a las cavidades orgánicas delimitadas por una membrana (duramadre, pleura y peritoneo), el carácter abierto hace referencia a la solución de continuidad en estas membranas, con los graves problemas que esta complicación provoca, desde la infección (meníngea, pleural o peritoneal) hasta un grave trastorno funcional (desequilibrio mediastínico con insuficiencia respiratoria aguda, en el llamado tórax abierto), debidos a la penetración del agente trau-
mático en estas cavidades, por lo que se conocen también como traumatismos penetrantes.
Podemos clasificar ahora a los traumatismos, de acuerdo con las estructuras anatómicas y sistemas orgánicos afectados, en los siguientes apartados:
Piel y tejido celular subcutáneo.
Aparato locomotor (huesos, articulaciones, músculos y tendones).
Sistema nervioso central (craneoencefálicos y medulares).
Sistema nervioso periférico.
Sistema vascular.
Tórax.
Abdomen.
Aparato genitourinario.
TRAUMATISMOS MECANICOS
CONTUSIONES
Definidas por la integridad cutánea, se producen por el impacto de objetos obtusos, estando en relación la intensidad de las lesiones con la fuerza desarrollada por el agente traumático, la cual es directamente proporcional a la masa de este agente y al cuadrado de la velocidad que adquiere (F = 1/2 mv2). Las lesiones aumentan cuando el impacto se realiza contra un plano óseo prominente, pudiendo llegar a producirse, a pesar de tratarse de un agente obtuso, una verdadera solución de continuidad de bordes magullados y parcialmente desvitalizados (herida contusa), esto sucede en las contu-
siones sobre el arco superciliar.
Bajo la integridad de la piel, o en todo caso de su abrasión, entendida ésta como la pérdida de la epidermis por acción mecánica, en el foco traumático de una contusión, se producen divisiones de los tejidos, roturas de los vasos capilares, y hemorragia en los intersticios subcutáneos; la extravasación sanguínea en el foco contusivo se hace aparente por las manchas sanguíneas de la piel (equimosis), en la zona del impacto. Cuando el tejido celular subcutáneo es laxo, la sangre extravasada puede extenderse a distancia del foco traumático por la acción de la gravedad (equímosis palpebrales, en las contusiones del reborde superciliar).
Si la sangre extravasada es abundante, y la disposición de los tejidos favorece la delimitación, se constituye una colección sanguínea o hematoma. (contusiones del cuero cabelludo).
En el hematoma, la cavidad donde asienta la colección sanguínea está recién formada por la destrucción localizada de los tejidos y la presión de la hemorragia, mientras que la acumulación de sangre en una cavidad natural se denomina de modo específico (hemotórax, como derrame pleural hemático, y hemoperitoneo, como sangre dentro de la cavidad peritoneal).
Se pueden formar también grandes hematomas, que acumulan tanta cantidad de sangre, que llegan a determinar una peligrosa disminución del volumen sanguíneo circulante (hipovolemia), con desarrollo de un estado de shock.
La sangre coleccionada en el foco de una fractura de la diáfisis femoral de un adulto puede alcanzar los tres litros, como también la hemorragia en el espacio retroperitoneal, en las fracturas de la pelvis.
Un hematoma se puede producir en circunstancias patológicas, cuando la débil acción energética del agente traumático no justifica la lesión y la consiguiente colección sanguínea: así sucede en los trastomos de la coagulación sanguínea (hematomas múltiples, en los sujetos que padecen hemofilia), o bien en previas alteraciones de los
tejidos traumatizados (hematomas del músculo recto anterior del abdomen, en las mujeres multíparas).
Una acción tangencial sobre la piel y el tejido celular subcutáneo, asentados sobre un plano resistente como la cara lateral del muslo sobre la fascia lata, puede producir derrames, predominantemente linfáticos (derrame seroso de Morel-Lavallée).
Los signos y síntomas clínicos de una contusión dependen de la importancia de las lesiones en el foco traumático, de las consecuencias o complicaciones derivadas y, en último término, de las estructuras y sistemas orgánicos afectados.
Una contusión en el hipocondrio izquierdo, además de producir equímosis sobre la cubierta cutánea de las últimas costillas, puede fracturar éstas y ocasionar, además, un desgarro en la estructura frágil del bazo; la consecuencia o complicación, que va a dominar el cuadro clínico, es la abundante hemorragia intraperitoneal (hemoperitoneo), que pone en peligro la vida del sujeto traumatizado.
Toda contusión, en definitiva, exige la puesta en marcha de una investigación clínica en profundidad, por estratos anatómicos, a partir de la localización superficial de la zona de impacto. Como ejemplos señalemos que, en la contusión del cuero cabelludo, es preciso descartar un traumatismo craneoencefálico, en la de las paredes abdominales, la existencia de lesiones viscerales, y en la del dorso de la mano, si existe o no fractura de un metacarpiano.
El tratamiento de una contusión depende del diagnóstico de sus consecuencias internas a la cubierta cutánea. El foco contusivo superficial exige calmar el dolor y frenar la reacción inflamatoria y el edema consiguiente con la aplicación local inmediata de compresas empapadas en agua helada, o una bolsa de hielo, mientras que, más tarde, el calor también disminuye el dolor y acelera la resolución del foco traumático. Los hematomas superficiales, situados sobre un plano óseo, pueden comprimirse en su fase de expansión si son asistidos inmediatamente. El grave peligro de una infección puede ser el resultado de la punción de un hematoma, por lo que ésta no debe aconsejarse fuera de indicaciones concretas como el gran hematoma de tejido subcutáneo, bien definido, y siempre contando con técnica aséptica (libre de gérmenes patógenos).
HERIDAS
Definidas por la solución de continuidad en la cubierta cutánea y frecuentemente, con una simultánea o diferida pérdida de sustancias, se producen
por la acción de diversos agentes traumáticos (agentes vulnerantes).
De acuerdo con la morfología del agente vulnerante, y la dirección en que se produce su impacto sobre la superficie cutánea, se distinguen:
Heridas incisas
Son producidas por instrumentos de hoja afilada y cortante, como el bisturí del cirujano, un cuchillo de cocina o una navaja; en ellas la longitud, supera a la profundidad de su penetración; los bordes son limpios, con mínima desvitalización de los tejidos y, bien irrigados, sangran abundantemente. La separación de estos bordes es tanto mayor cuanto más perpendicular es el corte a las líneas de Langer, a lo largo de las cuales la movilidad de la piel sobre los planos profundos es menor. Las heridas incisas por intento de suicidio, suelen encontrarse en el cuello y en las muñecas.
Heridas punzantes
Producidas por agentes traumáticos puntiagudos, crean una solución de continuidad externa mínima, puntiforme a veces, superada con creces por la profundidad anatómica que alcanzan. Una punción pleural a través de las capas de un espacio intercostal es una herida quirúrgica punzante, como lo es también la penetración del laparoscopio a través de la pared abdominal.
Las heridas punzantes accidentales se producen con cuchillos, navajas, agujas, punzones, o cualquier instrumento con extremidad puntiaguda, habitualmente en agresiones (puñaladas, navajazos) o intentos de suicidio.
Estas heridas, dependiendo del área anatómica afecta, pueden sangrar más en la profundidad que exteriormente, y presentan el grave riesgo de la infección, cuando el agente traumático deposita, en el seno de los tejidos, gérmenes que allí encuentran un ambiente deficitario en oxígeno, adecuado para su proliferación. Así, una herida punzante en la planta del pie, producida por un clavo abandonado, es siempre peligrosa por el elevado riesgo de infección tetánica.
Las heridas punzantes accidentales, después de atravesar las partes blandas, pueden penetrar en cavidades orgánicas (heridas penetrantes); en este grupo se incluyen las muy frecuentes heridas penetrantes por arma blanca, en las cavidades torácica y abdominal.
Heridas con colgajo
Si la dirección del agente vulnerante (navaja, bisturí) es oblicua o tangente a la superficie cutánea, se produce un corte a bisel que levanta un colgajo de los tejidos blandos. La sutura simple del colgajo produce una cicatriz curva, con elevación de los tejidos en el lado de la concavidad; la corrección de esta deformidad, indicada cuando asienta en la cara, se realiza alargando la cicatriz mediante plastias en Z.
Heridas contusas
La solución de continuidad se produce por agentes traumáticos obtusos, casi siempre actuando sobre un plano duro subyacente, como sucede en las prominencias óseas (herida contusa del arco superciliar). Los bordes se encuentran magullados,
desvitalizados, y sangran poco, apreciándose, a veces, pérdidas de sustancia en el contorno de la herida.
Heridas por arrancamiento o avulsión
El agente traumático actúa arrancando un área de tejidos orgánicos. El arrancamiento puede ser completo o parcial; en este último caso, se conserva una conexión o puente entre el tejido arrancado y el resto del organismo.
Los bordes están desvitalizados y sangran poco, con deficiente irrigación sanguínea en los arrancamientos parciales, lo que ha de tenerse en cuenta en el momento de la reparación.
Cuando el arrancamiento afecta a los planos superficiales, suele ocurrir en los tejidos pericraneales, en las extremidades inferiores, y en el escroto. Se trata de una denudación traumática de la piel.
En el cuero cabelludo (scalp), la avulsión se produce por tracción violenta de la cabellera, larga y no protegida, atrapada en una máquina (hasta ahora mayor frecuencia en la mujer). Puede ser parcial (con pedículo) o total, y en el primer caso cabe la posibilidad de que el colgajo sea repuesto después de su rasurado y limpieza, dada su rica vascularización, a no ser que en él se incluya el pericráneo. En la avulsión total, la porción desprendida no puede ser utilizada bajo ningún concepto, y es necesario recurrir a la aplicación de injertos sobre el pericráneo. Cuando éste ha sido arrancado, se plantean problemas de reparación más dificiles.
En las extremidades inferiores, la avulsión se origina cuando son aprisionadas por cilindros o rodillos de máquinas, o bien por los neumáticos de un automóvil en un atropellado. La piel y el tejido celular subcutáneo son separados, por mecanismo de cizallamiento, de los planos profundos, de modo inmediato o tardío, en este último caso en virtud de los graves trastornos circulatorios producidos por la rotura de las conexiones vasculares con la profundidad.
En realidad, se produce un desollamiento de la extremidad, en el sentido de «sacar la piel». El tratamiento es el recubrimiento inmediato con injertos, después de extirpar la piel inviable.
El arrancamiento puede afectar a toda una extremidad o parte de ella.
En el escroto, y también en el pene, la piel, laxa, puede ser desprendida de modo parcial o total, al ser aprisionada por cilindros de máquinas, e incluso por la brusca subida de la cremallera del pantalón. La reconstrucción precisa de técnicas especializadas de cirugía plástica.
Heridas por mordedura
Son producidas por la dentadura de una persona o animal.
En las mordeduras humanas, existen tres posibilidades de acuerdo con las circunstancias de la agresión: a) La mordedura activa, en la que el agresor clava sus dientes en la víctima, b) La automordedura, frecuente en la crisis epiléptica, en la que el
mordisco afecta a la lengua, labios, o cara interna de las mejillas, del propio sujeto. c) La mordedura pasiva, que comprende a las heridas producidas en el puño cerrado de un agresor, que golpea sobre el borde cortante de los dientes de una presunta víctima.
Las heridas por mordedura humana son heridas contusas, a veces con avulsión parcial o total (oreja, labios, nariz, manos), y con una intensa contaminación, ya que la cavidad oral humana es muy rica en gérmenes patógenos (estafilococos, estreptococos
no hemolíticos, anaerobios, bacilo de Vincent, espiroquetas, bacteroides), por lo que la probabilidad de infección es muy elevada, y las convierte en heridas potencialmente muy peligrosas. Estas características han de ser tenidas en cuenta en el momento de proceder a su tratamiento; por otro lado, en las mordeduras de los dedos son frecuentes las lesiones articulares y tendinosas, de pronóstico grave por el riesgo de infección fulminante. Las heridas recientes por mordedura humana presentan, a veces, la marca de los dientes y manifestaciones inflamatorias precoces; las observadas dos o más días después de su producción, muestran intensos fenómenos inflamatorios locales (edema, necrosis, exudado purulento) y regionales (linfangitis, adenitis).
En las heridas producidas por mordedura de perro (95 % de las heridas por mordedura animal) el peligro está en la posible inoculación de virus de la rabia, con mucho menor riesgo de otras infecciones inespecíficas.
La saliva del animal infectado de rabia es rica en este virus neurotrópico; acumulado en sus glándulas salivales, es inoculado en el tejido celular subcutáneo y se desplaza a lo largo de los nervios. La contaminación por lamido de animal rabioso, en erosiones o mucosas, es rara.
¿Qué hacer ante la mordedura de un animal sospechoso de estar afecto de rabia? Ante todo procurar la identificación y captura del animal, si es posible, para someterlo a control veterinario durante 5 a 10 días. Después de la limpieza quirúrgica
adecuada, y de lavar la herida con agua y jabón e irrigarla con cloruro de benzalconio al 1 %, tras eliminar los residuos de jabón que neutralizan el compuesto de amonio cuaternario, es recomendable atenerse al programa profiláctico en el que se realiza la inmunización activa ante un animal agresor muerto, desaparecido o comprobado enfermo.
El período de incubación de la rabia varía de unos pocos días a varios meses (generalmente entre 20 a 40 días). Se inicia con una fase de agitación, ansiedad, e irritabilidad a los estímulos (ruidos, luces), salivación excesiva, espasmos musculares faríngeos, y disfagia para líquidos (hidrofobia), y termina con una fase paralítica, en coma.
La mordedura de animales salvajes contaminados por el virus (zorros, murciélagos), puede también provocar la rabia; en los Estados Unidos la mayoría de casos confirmados de rabia ocurrieron por mordedura de animales salvajes.
Las heridas producidas por mordedura de gato afectan de modo preferente al miembro superior y a menudo, se acompañan de arañazos. El gato inocula una flora patógena variada, con el peligro de producirse una infección difusa del tejido celular
subcutáneo (celulitis), siendo capaz de inocular, incluso con simples arrancamientos del epitelio (excoriaciones) por arañazos, el virus de la linforreticulosis benigna. El gato también puede transmitir la rabia.
Las heridas por mordedura de rata se observan en niños muy pequeños, mantenidos sin la adecuada vigilancia y en ambientes de extrema pobreza; se acompañan de pérdidas de sustancias en las extremidades, nariz y orejas. Específica-
mente pueden inocular el Spirillum morsus muri, responsable de la enfermedad conocida como sodoku o fiebre por mordedura de rata (1.000.000 UI diarias de penicilina G, durante una semana).
Las heridas causadas por mordedura de serpiente venenosa, son peligrosas (75.000 muertes anuales en el mundo) por la inoculación de sustancias tóxicas para el organismo (heridas emponzoñadas).
El mecanismo que produce la inoculación del veneno es simple: la ponzoña, secreción de glándulas salivales, es excretada en el interior de los tejidos mordidos a través de un conducto intradentario, por la contracción de los músculos temporales
del animal que comprimen la glándula secretora.
La mordedura es muy parecida a una inyección hipodérmica, en la que además de la sustancia venenosa se inoculan gérmenes, preferentemente anaerobios.
La mordedura, casi siempre con la huella de dos orificios puntiformes en una pierna, produce dolor más o menos intenso, edema, eritema, equímosis, e incluso flictenas hemorrágicas.
Cuando la cuantía del veneno inoculado es importante, el síndrome local puede acompañarse de manifestaciones generales de envenenamiento, tales como taquicardia, taquipnea, fiebre, náuseas, e incluso estado de shock. En conjunto, los venenos de las distintas serpientes contienen sustancias activas, la mayoría caracterizadas como enzimas, que actúan de modo muy diverso en la sangre (acción coagulante o anti-coagulante o hemolítica), sobre la circulación (depresión del centro vasomotor) y el
sistema nervioso (acción similar a la del curare, paralizando el centro respiratorio) con proporciones variables de factores hemotóxicos y neurotóxicos.
El tratamiento de estas mordeduras es urgente, y precisa cumplir los siguientes objetivos: a) Retrasar la absorción del veneno a partir del foco traumático. La aplicación de un torniquete en la raíz del muslo, con la suficiente presión como para ocluir el retorno venoso permitiendo, sin embargo, el aporte arterial, es muy discutido pues esta medida agrava las lesiones locales. La extremidad será inmovilizada, debe producirse rapidamente el traslado a un centro que disponga de suero antiofídico
b) Extraer cuanto veneno sea posible del foco traumático, mediante incisión sobre los orificios de la mordedura y succión, que puede ser bucal (siempre que no existan lesiones en la mucosa oral de quien aspira) o instrumental (dispositivos mecánicos de aspiración). Asistido el paciente en los primeros momentos, en ambiente quirúrgico ade-
cuado, el procedimiento más seguro es la extirpación o exéresis del foco traumático, mediante una incisión en elipse, que comprenda en su área los orificios de la mordedura, profundizando hasta el plano aponeurótico, y seccionándolo ampliamente (fasciotomía).
c) Administración de hidrocortisona, 1 g por vía intravenosa, cada 4 horas, durante 72 horas, si hay signos y síntomas generales de envenenamiento. La dosis será menor (100 mg intramusculares cada 6 horas para adultos y 50 mg para niños), si no son manifiestos estos signos generales.
Para prevenir complicaciones infecciosas en el foco traumático, administrar un antibiótico de amplio espectro, como la ampicilina, a la dosis de 1 g cada 6 horas, por vía intramuscular o EV en los adultos y 250 mg cada 6 horas en los niños.
Profilaxis de la infección tetánica con gammaglobulina antitetánica liofilizada, a la dosis de 500 UI en los adultos, y 250 UI en los niños. Si el paciente había sido previamente inmunizado contra la infección tetánica, se le administrará solo toxoide antitetánico, de lo contrario se inicia la vacunación con el mismo.
d) Neutralizar el veneno, cuando existan manifestaciones generales, mediante la administración de sueros antiofidicos polivalentes si están disponibles.
Las manifestaciones generales exigen el ingreso del paciente en un hospital, y su tratamiento en el área de cuidados intensivos, con infusión intravenosa de líquidos y electrólitos, control de funciones vitales, etc.
Heridas por armas de fuego
Las especiales características de estas heridas dependen de la cuantiosa energía cinética del agente traumático, el proyectil; de su forma, peso, y de las acciones destructivas que puede desarrollar en el seno de los tejidos. La energía cinética del
proyectil (EC) puede expresarse por la fórmula:
En la que m = masa y v = velocidad. De esta fórmula se deduce que cuanto mayor sea la velocidad más intensa será la EC y que a igualdad de velocidad, el proyectil con mayor masa tendrá una EC más elevada.
De acuerdo con su energía cinética, los proyectiles se clasifican así: a) De baja EC cuando la velocidad es inferior a 365 m/seg. b) De mediana EC, con una velocidad entre 365 y 762 m/seg. c) De alta EC, con velocidad superior a 762 m/seg. El proyectil de una pistola o revólver es de baja EC (150-250), mientras que, por ejemplo, el rifle del
ejército británico, con 800 m/seg de velocidad, es de alta EC.
La bala se acerca a su blanco por un movimiento de traslación lineal combinado con otro helicoidal, mediante el cual consigue mayor estabilidad y este movimiento es acentuado por el rayado del ánima del rifle o fusil.
El proyectil necesita de una energía cinética mínima, de 50-60 m/seg, para penetrar la piel.
La energía cinética es absorbida por los tejidos orgánicos la que se convierte en energía traumática, destructora. El camino que sigue el proyectil se denomina trayecto, y depende de la EC de aquél y de la resistencia que encuentra. Si esta EC es suficiente, el proyectil no sólo penetra (orificio de entrada) sino que sale (orificio de salida)
Los estudios experimentales con fotografia de alta velocidad han permitido reconstruir lo que sucede en el trayecto de un proyectil por los tejidos, según su energía cinética: cuando la EC es baja, el proyectil disparado sobre una masa de gelatina al 20 %, con densidad parecida a los tejidos orgánicos, labra un simple trayecto por separación y compresión. En proyectiles de mediana y alta EC se producen dos fenómenos más: una onda de choque que avanza desde la puerta de entrada, y que desarrolla una elevadísima presión con valores calculados de 1,05 x 106 kg/m2, y un fenómeno de cavitación temporal. En este último, que puede observarse si se dispara sobre un bloque de gelatina, la elevada EC del proyectil desplaza hacia los lados y hacia delante aquella sustancia. Debido a la inercia de la gelatina, la cavitación aparece después de que el proyectil ha salido, desarrollando en su interior una presión subatmosférica que ejerce un efecto aspirativo de restos de los tejidos e incluso de cuerpos extraños, y que termina por colapsarse, dejando un trayecto lineal pero con fisuraciones laterales y extensas lesiones alrededor (lesiones por efecto explosivo).
También los proyectiles que alcanzan los tejidos orgánicos con un trayecto ya inestable, gastan más energía cinética en atravesarlos y producen más lesiones. Los disparos a corta distancia provocan también lesiones más intensas, porque en los
primeros 100 m la bala no ha alcanzado su plena estabilidad.
Los tejidos duros como el óseo, que por falta de elasticidad no pueden seguir la distensión de la cavitación temporal, estallan.
El disparo con un arma de alta energía cinética sobre un cráneo vacío provoca un orificio de entrada y otro de salida, permaneciendo el resto intacto; por el contrario, si rellenamos el cráneo con gelatina al 20 %, el disparo de la misma arma hará estallar el cráneo óseo, que no ha podido resistir la fuerte presión producida por la cavitación temporal de la gelatina.
Si la energía cinética se agota durante el recorrido del proyectil por los tejidos orgánicos, aquél quedará retenido, y el trayecto sólo tendrá un orificio de entrada. Este orificio es de menor diámetro que el de salida y más regular en su forma. En disparos a corta distancia el orificio de entrada presenta quemaduras de pólvora (Zona de tatuaje o ahumamiento). Las heridas de partes blandas cuando el proyectil sigue un trayecto recto, como sucede en la pantorrilla, que une los dos orificios, de entrada y de salida, se
denominan heridas en sedal.
Cuando en el trayecto del proyectil se producen impactos sobre objetos duros, ya con escasa energía cinética residual, se originan recorridos irregulares, con desprendimiento de fragmentos óseos como proyectiles secundarios.
Los proyectiles que no poseen un blindaje total tienen también mayor efecto explosivo dentro de los tejidos, ya que el plomo sin proteger se deforma y estalla.
Los artefactos que explotan en el aire o en el suelo provocan una lluvia de fragmentos de forma irregular, muy contaminados los que estallan en tierra, produciendo heridas con trayectos anfractuosos y múltiples (heridas por metralla).
Las heridas por disparo de escopeta dependen, en sus características, de la distancia a que se recibe el impacto: si se produce cuando los perdigones no han iniciado su dispersión, el efecto es similar al de una bala, pero con mayor efecto destructivo; si ocurre cuando la dispersión se está produciendo, la herida se hará mucho más peligrosa, con grandes orificios de entrada; por último, cuando la dispersión es máxima (perdigonada como accidente de caza) las heridas son múltiples y poco profundas, aunque pueden ser peligrosas, como ocurre con las lesiones oculares.
Ante toda herida por arma de fuego es muy importante el examen de sus orificios, la determinación de cuál es el de entrada y el de salida, si existen ambos, y la reconstrucción aproximada del trayecto, permitiendo la exploración radiológica
precisar la posición de los proyectiles retenidos.
Considerando que con frecuencia se afectan gravemente sistemas orgánicos (traumatismos craneoencefálicos, torácicos y abdominales), los heridos por arma de fuego precisan su ingreso urgente en un centro hospitalario con la finalidad de: a) Recu-
perar y mantener sus funciones vitales. b) Diagnosticar sus lesiones. c) Tratar cada una de ellas.
EL PROCESO BIOLOGICO DE LA CURACION DE LAS HERIDAS
Considerando que toda herida es una puerta abierta, por la que pueden penetrar cuerpos extraños y gérmenes (contaminación) y salir líquidos orgánicos, su cierre es una urgente necesidad. En las heridas muy superficiales, que no traspasan la dermis, se produce un cierre primario espontáneo por la toma de contacto de sus bordes, mientras que en las que existe una clara separación de éstos solamente la acción quirúrgica (sutura de la herida) puede conseguir este cierre primario. En uno y otro caso, la curación va a realizarse bajo los bordes cerrados de la herida, y se denomina primaria o por primera intención.
Cuando la curación tiene lugar con los bordes separados, aunque progresiva-mente aproximados por la «contracción» del tejido de granulación, todo el proceso se desarrolla a la vista hasta que, más tarde, el epitelio recubre el tejido que ha rellenado la pérdida de sustancia; a este modo de curación se la denomina secundaria, o por segunda intención.
El tratamiento quirúrgico procura realizar el cierre precoz con la mayor prontitud posible, salvo en aquellos casos en los que las características de la herida (abundante
contaminación e intensa desvitalización) justifiquen la consideración de este cierre como peligroso (desarrollo de infección). Las heridas operatorias realizadas en condiciones de escasa contaminación (técnica aséptica), y tratando de disminuir al mínimo posible la desvitalización de los tejidos (técnica atraumática, como desideratum), son un ejemplo cotidiano de cierre inmediato que busca la curación
por primera intención, la cual acelera y mejora el proceso curativo.
SECUENCIAS EN EL PROCESO DE LA CURACION
Limpieza del foco traumático y acumulación de material para la reparación
Se haya realizado o no previamente el cierre de una herida, su curación comprende una larga secuencia de fenómenos íntimamente relacionados entre sí.
Tras producirse la herida por el agente traumático, en el foco lesional se encuentran tejidos total o parcialmente desvitalizados, sangre extravasada, cuerpos extraños, y gérmenes.
La respuesta local frente a estas lesiones, que suponen una ruptura de la homeostasis, entendida ahora como equilibrio biológico dentro del área lesionada, es el desarrollo progresivo de un estado de inflamación aguda que va a cumplir, sucesiva-mente, dos objetivos: 1) Limpieza del foco traumático, y acumulación del material necesario para la reparación.
2) Formación de colágeno y aumento de la resistencia a la separación de los bordes de la herida.
La epitelización se produce precoz o tardíamente, dependiendo de si la herida está cerrada (cierre por primera intención) o abierta (por segunda intención).
La respuesta local a la agresión es prácticamente la misma frente a un traumatismo, una contaminación bacteriana, o un cuerpo extraño. El fenómeno inflamatorio agudo es una reacción compleja, con etapas sucesivas pero integradas.
Pueden distinguirse dos componentes:
a) Respuesta vascular. La respuesta inmediata, en el área afecta, es una vasoconstricción transitoria, producida en parte, por la liberación de tromboxano, una prostaglandina, por las plaquetas, seguida de vasodilatación activa. Coincidiendo con esta vasodilatación, se observa un aumento de la permeabilidad vascular.
La filtración de líquido plasmático provoca un edema intersticial, rico en proteínas, anticuerpos, complemento, agua y electrólitos, que es la atmósfera biológica adecuada para el desarrollo de los próximos fenómenos reparativos.
La responsabilidad de este aumento de la permeabilidad vascular, que se produce a través de las junturas endoteliales, recae en las aminas vasoactivas (histamina, serotonina), en las cininas, y en las prostaglandinas (PG); la histamina es liberada por
los mastocitos, y también por las plaquetas, no durando su acción más de 30 min. La acción de la serotonina, es casi indistinguible, en este aspecto, de la producida por la histamina. Las cininas (bradiquinina o kalidina) son liberadas a partir de una a2-globulina del plasma (cininógeno), por la acción de la kalicreína, a su vez activada por el factor XII (Hageman). Su modo de acción es similar al de las aminas vasoactivas, y su duración es corta. Otras prostaglandinas, sobre todo la prostaciclina, y también las E1 y E2, poseen una fuerte acción vasodilatadora, acompañada de un aumento de la permeabilidad capilar venosa y del flujo linfático.
La agresión estimula, en el foco traumático, a las fosfolipasas de las membranas celulares, las cuales, a su vez, hidrolizan los fosfolípidos para liberar precursores de las PG, como el ácido araquidónico: estos ácidos poliinsaturados son convertidos en varias prostaglandinas entre ellas tromboxano, producido por las plaquetas, y prostaciclina, generada en las células endoteliales. Entre las aminas, cuya acción puede ser modulada por las PG, estarían la serotonina y la histamina.
Fracciones del complemento C3a y C5a (anafilotoxina) también estarían involucrados en esta etapa de la respuesta inflamatoria cicatrizal, así como Citocinas mediadoras primarias, Interleucina 1 (IL1), Factor de necrosis tumoral (TNFa), o bien beta1 o gamma Interferón), la IL1 actuaría sobre el eje hipotalamohipofisosuprarrenal, liberando ACTH y glucocorticoides, e induciría a la síntesis de IL6, que actuaría a nivel general.
La sustancia fundamental del tejido conectivo, compuesta de glicoproteínas macromoleculares y mucopolisacáridos, se altera captando agua y transformando su estado fisico de gel a sol.
b) Movimientos celulares. Coincidiendo con la vasodilatación, se producen los fenómenos de marginación, adherencia, y diapédesis de los granulocitos neutrófilos, que son las primeras células que aparecen en el foco traumático. Los leucocitos, atraídos químicamente (quimiotaxis), comienzan la acción fagocitaria de los gérmenes contaminantes y de los cuerpos extraños. Las células destruidas también son eliminadas por autólisis o heterólisis.
Si las lesiones necróticas de los tejidos en el seno de la herida son extensas, con abundantes cuerpos extraños, y fuerte contaminación, la limpieza de la herida será dificil que se cumpla con la acción fagocitaria, a pesar del esfuerzo que supone la llegada posterior de los macrófagos. El conjunto de los leucocitos muertos y a medio destruir, repletos de bacterias y de detritos, en el seno del exudado inflamatorio, constituye el pus (herida supurada), lo que significa el fracaso de la limpieza espontánea de la herida, con una respuesta inflamatoria excesiva pero, en cierto modo, ineficaz, ya que no ha conseguido la reparación.
La presencia de macrófagos es esencial para la reparación, no sólo por la acción complementaria de limpieza, sino por un mecanismo, no bien conocido, mediante el cual atraen a los fibroblastos al foco traumático. Por otra parte, los linfocitos no son imprescindibles para el proceso curativo, aunque contribuyen al mecanismo inmuno-defensivo.
En el seno de la herida se produce, por la acción de proteasas neutras liberadas por los leucocitos, una acción destructiva colagenolítica, que es excesivamente activa en presencia de tejidos desvitalizados, bacterias, sangre, y déficit de irrigación sanguínea, conduciendo entonces al desarrollo de una cavidad rellena de pus (absceso).
Ante la presencia de numerosos cuerpos extraños en una herida, como pueden estimarse las suturas y ligaduras, la reacción de limpieza leucocitaria es completada, y posteriormente sustituida, por los macrófagos (monocitos); se desarrolla entonces una
forma de inflamación crónica (granuloma de cuerpo extraño), ante un invasor o un elemento extraño que no puede ser liquidado.
Los movimientos celulares en el foco traumático terminan con la aparición del fibroblasto, que se detecta ya en las primeras 24 horas, alcanzando un número muy elevado a las 72 horas.
El fibroblasto está dotado de una gran capacidad secretora, y para ello contiene un retículo endoplasmático muy desarrollado, cuyo producto final es el tropocolágeno.
Las células primordiales del mesénquima tienen la capacidad de transformarse en fibroblastos, estimándose que la mayoría de éstos proceden de células locales, situadas en la adventicia de los vasos sanguíneos.
La función de los fibroblastos, célula básica de la reparación, es sintetizar los dos componentes básicos del tejido conectivo: el colágeno, y los mucopolisacáridos de la sustancia fundamental.
De modo paralelo a la proliferación de fibroblastos, se produce también el aumento de las céluas endoteliales, como componentes de la neoformación de capilares. Los vasos capilares neoformados se proyectan como evaginaciones, que sirven de eje a un tejido conectivo muy joven.
La proliferación de fibroblastos depende de su cercanía a dichas digitaciones vasculares que le aportan oxígeno.
El conjunto de brotes capilares y fibroblastos constituye el mamelón angioblástico, cuya suma es el tejido de granulación, sólo visible en las heridas que curan por segunda intención.
Cumplida con éxito esta fase de la curación, se ha producido la limpieza de la herida, y se ha acumulado el material celular y extracelular necesario para culminar el proceso biológico de la reparación. Comienza ahora la segunda fase.
Formación del colágeno y aumento de la resistencia a la separación de los bordes de la herida
A partir del quinto día del inicio del proceso de la curación, limpia la herida y acumulado el material necesario, comienza una fase eminentemente anabólica, en la que el fibroblasto, célula pleomórfica, sintetiza la sustancia precursora del colágeno, el tropocolágeno; de un modo paralelo, irá aumentando en la herida la resistencia a la separación de sus bordes.
La actividad secretora del fibroblasto tiene una base estructural evidente, con un retículo endoplasmático muy desarrollado. Bajo determinadas circunstancias, no bien conocidas, estos fibroblastos adquieren características muy similares a las de las células musculares (mioflbroblastos) y como veremos más adelante, juegan un papel fundamental en el fenómeno de la contracción de la herida.
En la estructura del colágeno son características:
a) La existencia de tres cadenas lineales péptidas, de igual longitud, en disposición helicoidal.
b) La presencia de glicina
c) La presencia de hidroxilisina e hidroxiprolina.
Desde el punto de vista bioquímico, la hidroxiprolina, no puede ser
incorporado directamente a la molécula del colágeno, sino tras la hidroxilación previa del aminoácido precursor, la prolina; exactamente lo mismo sucede con la formación de la hidroxilisina, a partir de la lisina.
En el mecanismo de producción de ambos aminoácidos intervienen unas enzimas, prolilhidroxilasa y lisilhidroxilasa, además de otros cofactores, entre ellos el ácido ascórbico.
Cuando el tropocolágeno no se ha polimerizado es completamente soluble en agua fría, mientras que la molécula de colágeno mantiene ya una cohesión interna mediante enlaces intramoleculares; la agregación de moléculas de colágeno para formar
fibrillas, comporta la formación de fuertes enlaces intermoleculares covalentes responsables de la insolubilidad del colágeno. A este proceso se le denomina de la maduración del colágeno.
Colágeno y resistencia de la herida a la separación de sus bordes
Existe una relación lineal entre la progresiva deposición de fibras de colágeno en el foco traumático y el aumento de la resistencia de los bordes de la herida a la separación.
En lo que al colágeno se refiere, su mayor resistencia va unida también a un proceso de remodelación, por el cual sus fibras tienden a orientarse a lo largo de las líneas de tensión de la zona anatómica donde asienta la herida; este proceso exige la destrucción de cierto número de fibras (actividad colagenolítica) y la producción de otras nuevas.
Epitelización de la herida y relaciones entre epitelio y mesénquima
En las heridas cerradas (curación por primera intención), como puede ser una herida quirúrgica suturada, la proliferación del epitelio se inicia rápidamente, y en 48 horas ha rellenado el mínimo defecto existente entre ambos bordes aproximados, cuando todavía no se ha formado colágeno en el seno de la herida.
Ante el estímulo de la lesión, se pone en marcha la actividad mitótica de las células basales fijas y de algunas del stratum spinosum. La emigración celular parece ser inducida por un mecanismo de feed-back negativo, según el cual las células epiteliales se mueven si pierden el contacto con otra célula similar (contact inhibition).
La emigración epitelial penetra en la V que forman los bordes de la herida, y también lo hace por los orificios de sutura paralelos al borde de la herida.
Heridas abiertas
El proceso de la contracción.
En una herida que está curando por segunda intención, con el tejido de granulación a la vista, se desarrolla un proceso de contracción en virtud del cual sus bordes se acercan concéntricamente, disminuyendo el área granulante; este proceso, descripto por J. Hunter se denomina contracción de la herida, diferente de la contractura definitiva de una determinada área anatómica, que puede ser la consecuencia de una contracción excesiva. Este proceso es independiente del de la epitelización, desarrollándose por un mecanismo activo situado a nivel del tejido de granulación.
Hoy sabemos que el tejido de granulación contiene fibroblastos que desarrollan características propias de la fibra muscular lisa; dichas células contienen un sistema fibrilar citoplasmático que se marca con suero humano anti-fibra muscular lisa, y muestran actividad contráctil celular. Por último, ha sido posible extraer actomiosina del tejido de granulación.
MODALIDADES DE LA CURACION DE LAS HERIDAS EN DIFERENTES TEJIDOS
Heridas tendinosas. Como el tendón maduro no contiene células capaces de realizar la síntesis del colágeno, y constituir la cicatriz que una los cabos seccionados, la curación se produce a partir de células extratendinosas, por lo que puede afirmarse que el tendón, totalmente aislado de su contorno hístico, es incapaz de repararse. Tras la formación
de la cicatriz, que restablece la continuidad tendínosa, se desarrolla un proceso de remodelación que separa el tendón de su contorno para permitir su deslizamiento.
Heridas musculares. Las heridas de los músculos estriados curan por un proceso mixto: regeneración de miofibrillas y formación de cicatriz conectiva. Mientras más precisa es la exéresis del tejido muscular desvitalizado y la aposición de los cabos
musculares, menor es la cicatriz fibrosa y mejor el resultado funcional.
Lesiones óseas (fracturas). Las soluciones de continuidad en el hueso curan por un proceso de regeneración limitado, pero capaz de restaurar su estructura, incluyendo la medula ósea.
Heridas de los nervios. Así como la célula nerviosa lesionada es incapaz de regenerarse, la fibra nerviosa, como extensión del citoplasma de esta célula, puede hacerlo. Por otro lado, el cabo distal del nervio seccionado sufre un proceso de degeneración walleriana, y en el cabo proximal se producen brotes de los axones y de la vaina de mielina.
Heridas peritoneales. Los defectos de continuidad en la superficie peritoneal, regeneran por la transformación (metaplasia) de las células mesodérmicas sub-peritoneales en células mesoteliales, y no a partir de los bordes de la pérdida de sustancia.
Heridas hepáticas. El tejido hepático está dotado de una extraordinaria capacidad de regeneración, muy superior a la de cualquier otro órgano. Esta regeneración puede compensar pérdidas de sustancia hepática que alcancen hasta un 80 % del volumen total, y se realiza por una combinación de actividad mitótica e hipertrofia de las células supervivientes.
Heridas intestinales. De las diferentes capas que forman la pared intestinal, es la submucosa la fundamental para el proceso reparativo, ya que a partir de ella se origina la cicatriz. La capa serosa (peritoneo visceral) es importante para el cierre inmediato
por aposición de sus bordes con fibrina.
FACTORES QUE INFLUYEN EN LA CURACION DE LAS HERIDAS
La secuencia normal de los fenómenos que se producen en el proceso biológico de la curación de una herida, puede verse alterada por hechos relacionados con lo que sucede en el propio foco traumático (factores locales), o bien con las condiciones generales del organismo del paciente traumatizado (factores generales). En todo caso, la respuesta local a la agresión induce una respuesta general, que a su vez puede estar condicionada por otras agresiones locales simultáneas (sujeto politraumatizado) y por afecciones sistémicas previas.
La curación de la herida es un proceso claramente anabólico con síntesis proteica, que ocurre durante un período en que la respuesta general a la agresión, es catabólico, con balance energético negativo. Mientras que el resto del organismo aparece como donador de sustratos, la herida hace de acumulador selectivo de material para la reparación.
Esta situación de la herida ha de justificarse por una «prioridad biológica», que sólo dura varias semanas, en interés de la supervivencia.
Factores locales
1. Cuantía de la desvitalización de los tejidos en el foco traumático.
Una destrucción excesiva de tejidos en el foco de la herida alarga la fase de limpieza en la respuesta inflamatoria, al tiempo que facilita el paso de la contaminación a la infección, con lo que se retrasa o bloquea el desarrollo de la fase reparativa.
En estas circunstancias, tan sólo la eliminación quirúrgica de los tejidos desvitalizados puede evitar esta grave interferencia.
2. Cuantía de la contaminación bacteriana.
Las heridas accidentales (producidas en ambiente sin asepsia quirúrgica), han de considerarse como contaminadas. La infección ocurre cuando el número de micro-organismos de la contaminación excede a la capacidad defensiva local.
Por otro lado, la presencia de cuerpos extraños, tejido desvitalizado, y sangre ex-travasada, agota las defensas locales y propicia la infección, con cifras relativamente bajas de contaminación. La capacidad defensiva de un sujeto puede estar globalmente disminuida, como sucede, por ejemplo, en los pacientes sometidos a tratamiento con fármacos inmunosupresores.
El mejor método para prevenir la infección de una herida es facilitar su limpieza, sin interferir con el proceso natural de su curación, por lo cual siguen siendo válidos los postulados técnicos de Halsted: manipulación cuidadosa de los tejidos, hemostasia eficaz operatoria, cierre de la herida sin tensión de las suturas, con obliteración de los espacios muertos, siempre que esta curación por primera intención se estime sin riesgo, dada la contaminación de la herida y la suma de los factores que pueden potenciarla, convirtiéndola en infección.
De acuerdo con el grado presumible de contaminación bacteriana, las heridas pueden clasificarse en:
a) Limpias. Como tales, pueden considerarse a las heridas quirúrgicas que no penetran en el tubo digestivo ni en las vías respiratorias, y que se realizan sin fallos en la técnica aséptica.
b) Probablemente contaminadas. Heridas quirúrgicas con penetración en el tubo digestivo o en las vías respiratorias, y sin contaminación excesiva.
Heridas con apertura de vías biliares y urinarias.
c) Contaminadas. Todas las heridas traumáticas o accidentales, y las heridas quirúrgicas con signos de inflamación aunque sin exudado purulento.
d) Muy contaminadas o sucias. Son las heridas con exudado purulento, las accidentales con intensa desvitalización y cuerpos extraños y las quirúrgicas puestas en contacto con el contenido de una víscera hueca perforada (perforación ulcerosa gastroduodenal, o apendicitis aguda).
3. Hematomas en el seno de la herida. La presencia de una colección de sangre entre los bordes afrontados de la herida retrasa la curación, porque aumenta las posibilidades del paso de contaminación a infección, tiende a separar, si es voluminosa, los bordes de la herida y por último, la presencia del ion férrico interfiere la capacidad defensiva local.
4. Cuerpos extraños. Suturas y ligaduras. La presencia de monocitos en el foco traumático, en cuantía superior a la habitual, indica la persistencia de cuerpos extraños que los polinucleares han sido incapaces de destruir. Se desarrolla, ante cuerpos
extraños resistentes a la disolución, una reacción inflamatoria crónica, granulomatosa, frente a un invasor que no puede ser liquidado y que, en último término, interfiere el proceso de la curación.
Los materiales de sutura y ligadura se comportan también como cuerpos extraños en el seno de la herida, induciendo una reacción inflamatoria que, de acuerdo con las características del hilo de sutura, puede terminar en la absorción o la eliminación al exterior. Si el número de estos cuerpos extraños es excesivo, la reacción inflamatoria
puede afectar a la curación de la herida, propiciando la infección.
Las suturas que utiliza habitualmente el cirujano son de dos tipos:
a) Suturas absorbibles, constituidas por colágeno animal especialmente tratado (catgut), o por material sintético como el ácido poliglicólico (Dexon(R)); las suturas de catgut, que se comportan como heteroinjertos de colágeno, despiertan una reacción inflamatoria que es más intensa en el catgut simple que en el crómico (combinado con óxido de cromo), éste con absorción más lenta.
El catgut es digerido por la acción de proteasas ácidas, producidas por las células del proceso inflamatorio.
Las suturas de ácido poliglicólico se hidrolizan lentamente por el agua, y su desaparición se produce entre los 100 y 120 días. Cuando las suturas absorbibles se hidrolizan, o son atacadas por las proteasas, pierden su tensión antes de ser digeridas así, el catgut ha perdido el 50 % de esta tensión entre los 20 y los 30 días, y el Dexon(R) en menor tiempo.
b) Suturas no absorbibles. Entre ellas éstan la seda, el algodón, el nylon, el poliéster
(Dacron), el polipropilene (prolene) y el acero.
La reacción inflamatoria ante una sutura no absorbible es, en general, menos intensa que ante las absorbibles, siendo el orden decreciente de intensidad para la seda,
algodón, poliéster, nailon, polipropilene, y acero.
Las suturas constituidas por varios filamentos (multifilamento) permiten que las
bacterias penetren entre aquéllos y no a las células inflamatorias, por lo que facilitan su indemnidad ante la limpieza espontánea y su posterior proliferación.
5. Tensión de O2 en la herida. Todo lo que interfiere el aporte óptimo de O2 al foco traumático retrasa el proceso curativo. El oxígeno es esencial para la curación de una herida, por varias razones:
a) El tejido de granulación consume O2 (producción de energía).
b) El O2 molecular es necesario para la hidroxilación de la prolina y la lisina durante la síntesis del colágeno, junto con el hierro, el alfa-cetoglutarato, y el ácido ascórbico (síntesis del colágeno).
c) Los fibroblastos no proliferan en cultivos sin O2, y necesitan una PO2 local óptima.
La velocidad según la cual progresa el borde del tejido de granulación está limitada por el aporte de O2, que le llega por los vasos capilares neoformados.
Desde el punto de vista práctico, esto quiere decir que es preciso mantener una función
cardiopulmonar suficiente con una volemia adecuada a nivel general y, a nivel local, evitar las suturas demasiado prietas que interfieren la circulación sanguínea en los bordes de la herida.
Factores generales o sistémicos
1. Edad del paciente. La posible disminución de las posibilidades reparativas en pacientes de edades avanzadas no depende directamente de la edad en sí, sino de una mayor acumulación estadística, a este nivel cronobiológico, de afecciones que interfieren el proceso curativo, como la diabetes, la arteriosclerosis, la hipoproteinemia, y la hipovitaminosis C, las cuales facilitan la infección que hace fracasar la reparación.
2. Desnutrición e hipoproteinemia. Un estado de desnutrición grave y, dentro de este déficit energético global, una hipoproteinemia, retrasa el proceso reparativo alargándose la fase de acumulación de materiales, con débil resistencia a la separación de los bordes de la herida, que dura más de lo normal. La consecuencia clínica será la apertura espontánea, total o parcial, de la herida operatoria (dehiscencia), al retirar los puntos de sutura, sobre todo en las heridas sometidas a gran tensión, como sucede en las abdominales, y aún en presencia de aquéllos (evisceración). Es muy importante el control de la proteinemia en los pacientes quirúrgicos.
3. Ictericia y curación de las heridas. Se ha demostrado un retraso en la reparación con una disminución de la resistencia a la separación de los bordes en el grupo ictérico, frente al control..
4. Administración terapéutica de corticosteroides. La cortisona retrasa el proceso
curativo a partir de determinadas dosis farmacológicas. El mayor efecto de la cortisona parece ejercerse sobre la proliferación capilar y la fibroplasia.
La conclusión práctica es que en los pacientes sometidos a terapéutica cortisónica, con
dosis elevadas y durante períodos prolongados, es preciso vigilar cuidadosamente el proceso de la curación de la herida, asegurando las suturas y manteniéndolas más tiempo de lo habitual.
5. Cinc. El cuerpo humano contiene de 1 a 2 g de cinc, actuando como cofactor esencial para diversas enzimas. Las manifestaciones clínicas de su déficit son diarreas, depresión mental, dermatitis perioral y perinasal, y alopecia.
En politraumatizados, y sobre todo en quemados, se observan concentraciones bajas de cinc, con retraso en el proceso reparativo.
6. Vitamina C. El ácido ascórbico interviene como cofactor en la síntesis de la hidroxi-prolina para la formación del colágeno.
En los sujetos en los que se sospecha esta hipovitaminosis, la administración de 500 a 1.000 mg de vitamina C diarios, en el período postoperatorio, está indicada.
7. Vitaminas A y E. No hay evidencia de que la administración de vitamina A modifique la velocidad de curación de las heridas, la vitamina E se ha recomendado como estabilizadora de las cicatrices.
8. Antiinflamatorios. La aspirina y la indometacina, interfiriendo la acción de las prostaglandinas, afectan indudablemente al proceso inflamatorio, pero a las dosis usadas, dificilmente pueden alterar de modo significativo el proceso reparativo.
9. Sustancias citotóxicas. La mayoría de estas sustancias, administradas en pacientes con neoplasias, interfieren el proceso de reparación.
PRINCIPIOS FUNDAMENTALES PARA EL TRATAMIENTO DE LAS HERIDAS
El objetivo primario y óptimo es conseguir la curación de la herida por primera intención, es decir, mediante el cierre o sutura inmediata de sus bordes, así como la recuperación funcional del área.
Pero el cierre inmediato o primario de la herida, sólo puede realizarlo el cirujano cuando está convencido de que la contaminación ha sido reducida hasta límites que impiden, el desarrollo de la infección. De lo contrario, se desarrollará la infección en el foco traumático impropiamente cerrado, ocasionando complicaciones
locales, tales como la inflamación del tejido celular subcutáneo que rodea a la herida (celulitis o flemón), la colección supurada en el seno de aquélla (absceso) e incluso, manifestaciones generales de una infección invasiva (sepsis).
El cirujano puede reducir la contaminación de una herida:
a) Mediante la utilización de técnicas que previenen la contaminación microbiana de los tejidos que se denomina asepsia o técnicas asépticas.
b) Previniendo la infección, a través de la aplicación local de sustancias químicas que exterminan (acción bactericida) o frenan (acción bacteriostática) la proliferación de los gérmenes, que ya contaminan los tejidos vivos del foco traumático. Este procedimiento se conoce como antisepsia, y a las sustancias químicas usadas con este fin, antisépticos. Habitualmente, los antisépticos (como la tintura de yodo) sólo se aplican en la piel contaminada que rodea la herida o en la que se va a practicar la incisión, y no sobre los tejidos desprovistos de epitelio, con el fin de no lesionarlos, pero actualmente polivinilpirrolidona yodo, se utiliza en distintos tejidos.
c) Por medio de la extirpación quirúrgica, con bisturí o tijera, de los bordes contaminados de una herida accidental, así como de los tejidos desvitalizados o necrosados que existan en su interior, extrayendo, además, los cuerpos extraños retenidos. A esta técnica de limpieza quirúrgica del área contaminada se la denomina exéresis de la herida, en cuanto que trata de extirpar en bloque dicha área como si se tratase de un tumor; es el clásico método de Friedrich (1864-1916).
En las heridas operatorias se combinan, desde antes de su realización, dos procedimientos, la asepsia y la antisepsia, por lo que estas lesiones pueden considerarse, en su mayoría, como limpias o probablemente contaminadas, y se cierran inmediatamente después de terminada la intervención (cierre primario).
En las heridas accidentales, la combinación de asepsia, antisepsia y exére-
sis de la herida, después de su producción, tiene como objetivo conseguir una herida limpia, es decir, por debajo del nivel de contaminación que hace temer el desarrollo de una infección. Esta herida, ya limpia tras el tratamiento quirúrgico adecuado, podrá cerrarse inmediatamente.
Sin embargo, cuando la contaminación es macroscópicamente masiva
(herida sucia con tierra), o el tiempo transcurrido desde su producción y su contaminación es superior a ciertos límites, la proliferación de los gérmenes desborda las fronteras del foco traumático. En estas condiciones es dificil conseguir, mediante los tres procedimientos, asepsia, antisepsia y exéresis, una herida limpia inmediatamente, es
decir, que pueda cerrarse de modo primario.
En las heridas accidentales (producidas en condiciones no asépticas), el planteamiento en cuanto a la contaminación está fundado en la consideración de dos factores: a) El
aspecto de la herida; b) El tiempo transcurrido desde su producción y contaminación.
En el aspecto de la herida, son factores negativos para el cierre inmediato los siguientes: la suciedad del foco traumático (presencia de cuerpos extraños), la cuantía de la necrosis y desvitalización de los tejidos (heridas contusas, con extensas lesiones musculares, por arrancamiento o avulsión o por mordedura), la insuficiente irrigación sanguínea del área traumática y de la presencia de signos de inflamación invasiva (celulitis alrededor de la herida con enrojecimiento, aumento de la temperatura local, edema y dolor).
Las heridas punzantes con solución de continuidad externa mínima, pero con inoculación de gérmenes en profundidad (como ocurre en las heridas por un clavo en la planta del pie), crean, en el espesor de los tejidos, fondos de saco en los que se dan condiciones anaerobias muy peligrosas, que contraindican el cierre inmediato tras la escisión de la puerta de entrada.
El tiempo transcurrido desde la producción y contaminación de la herida, hasta su presentación al cirujano, es un factor muy importante para juzgar si se ha alcanzado ya la etapa de la infección.
La regla es el límite de las 6 horas, dentro del cual podría hacerse la escisión y el cierre inmediato; traspasado este límite horario, la herida no podría ser cerrada, puesto que la infección invasiva estará ya puesta en marcha.
Las opciones del cirujano, cuando de la contaminación se ha pasado ya a la infección, o al menos tiene fuertes dudas de que esto haya sucedido son las siguientes:
a) En caso de duda, realizar la exéresis según los postulados de Friedrich, con el objetivo de lograr una herida no contaminada. Mantenerla abierta, con tratamiento local y general antibacteriano, y revisarla transcurridos 4 días; si después de este plazo no se encuentran signos de infección en la herida y sus contornos, puede procederse a la sutu-
ra de sus bordes: ésta es una sutura primaria diferida.
b) Cuando predominan los factores negativos, extirpar los tejidos desvitalizados del foco traumático, extraer los cuerpos extraños, y mantener la herida ampliamente abierta para que fluyan al exterior sus exudados (drenaje). A este procedimiento técnico, cuya finalidad es conseguir la curación por segunda intención teniendo a la vista el tejido de granulación, se le conoce como debridamiento, a partir de la experiencia quirúrgica en la guerra europea de 1914 a 1918 (débridement).
Si el área granulante es poco extensa, puede llevarse a cabo, después de transcurridos 12 ó 15 días, una disección de los bordes de la herida, separándolos del tejido de granulación y procediendo a la sutura sin tensión (sutura secundaria).
Si el área de granulación es más extensa, y no se puede conseguir la fácil aposición de los bordes de la herida, se recurre a la colocación de un injerto de piel.
Si no se realiza alguna de estas técnicas, la contracción de la herida terminará por producir una cicatriz deforme, con epitelización incorrecta y con frecuencia, con incapacidad funcional en el área afectada (cicatrices retráctiles).
NORMAS PRACTICAS PARA EL TRATAMIENTO QUIRURGICO DE LAS HERIDAS
Tratamiento de una herida contaminada
Como tal consideramos aquí a toda herida accidental que no presenta signos de infección.
1. Cubrir la herida con gasas estériles.
2. Examen de las estructuras anatómicas que atraviesan el área de la herida, y sus posibles alteraciones funcionales: En una herida de la cara ha de explorarse la función del nervio facial, y la continuidad del conducto parotídeo (peligro de fistula salival externa); en una de la mano, se explorará la movilidad y sensibilidad de los dedos, en relación con la localización de la herida.
3. Si no existen signos de lesiones en estructuras internas (tendones, nervios, huesos, vasos), la herida puede ser asistida en una sala de curas de urgencia (moderadas condiciones asépticas), o en un quirófano (máximas condiciones asépticas).
4. Veinte minutos antes de la intervención, conviene aliviar al paciente si se queja de intenso dolor (meperidina) y tranquilizarlo (hidroxicina).
5. Rasurar la piel alrededor de la herida, y después de lavar con agua y jabón durante 5 min, a ser posible conteniendo hexaclorofeno, se trata la superficie con varias capas de povidona-yodada, aplicadas desde los bordes hacia fuera.
Puede usarse, también, la tintura de yodo al 2,5 %, o la de Merthiolate(R), que es un compuesto orgánico de mercurio. En las heridas de la cara, la solución antiséptica no debe ser irritante, siendo recomendable el cloruro de benzalconio.
6. Si se decide la anestesia local (anestesia local por infiltración), de lidocaína o novocaína en solución al 1 %. En localizaciones concretas, como la mano o el pie,
puede utilizarse la anestesia por bloqueo nervioso regional.
7. Levantar las gasas que recubren la herida e irrigarla, copiosamente, con suero salíno fisiológico templado. Se rodea el área preparada con toallas estériles.
8. Extirpar de 2 a 3 mm de los bordes, frecuentemente contundidos, de la herida, con bisturí, y resecar con tijeras las zonas desvitalizadas en su cavidad. Tras esta limpieza quirúrgica se hace una nueva irrigación de la herida.
9. Recubrir la herida con gasas, retirar las toallas, cambiarse de guantes, y colocar nuevas toallas estériles. Se procede entonces a la hemostasia de la herida, pinzando los vasos sangrantes y colocando el menor número de ligaduras posible, ya que actúan como cuerpos extraños.
10. Es el momento de decidir si la limpieza de la herida permite el cierre inmediato (cierre o sutura primaria). Si ésta es la indicación, se cierra la cavidad de la herida por planos anatómicos, anudando los hilos sin tensión para evitar la isquemia en los bordes, y procurando no dejar espacios muertos donde se coleccionan hematomas o seromas. Los bordes de la herida se unen a nivel de la piel con material no absorbible, retirándose los puntos entre el 7° y el 8.° día; en la cara se mantienen menos tiempo (4 ó 5 días), para evitar las marcas de las suturas.
11. Si la decisión es efectuar una sutura primaria diferida, la cavidad de la herida se rellena y recubre con gasas simples, yodofórmicas, o vaselinadas, y se asegura el cierre con un vendaje. El paciente se somete a terapéutica antibiótica, por vía oral, E.V. o intramuscular, y la herida es revisada al cuarto día.
Si no existen signos de infección, ésta se cierra.
Tratamiento de una herida intensamente contaminada o infectada
Como tales consideramos a aquellas en las que predominan los factores negativos tanto en las características de la herida como en el tiempo transcurrido, favorables al desarrollo de la infección, o bien ésta es ya evidente.
Si existen signos de inflamación invasiva -celulitis- alrededor de la herida, no podrá utilizarse la anestesia local por infiltración, y será necesario recurrir a la anestesia general.
El objetivo de la limpieza quirúrgica no es la escisión de la herida, sino la apertura amplia de su cavidad (desbridamiento), para permitir la salida al exterior de sus exudados (drenaje).
Los cuerpos extraños deben ser extraídos, así como los tejidos necrosados y desprendidos. En el debridamiento, no se trata de extirpar la herida en bloque, sino de dejarla lo más limpia posible y abierta.
Como la decisión en cuanto al cierre tiene que ser una sutura secundaria, la herida es recubierta con gasas estériles simples, o mejor yodofórmicas, y el paciente se somete a terapéutica antibiótica general, y curas cada 3 ó 4 días, vigilando la formación de un tejido de granulación.
Entre los 12 y 15 días, cuando el tejido de granulación ha rellenado la cavidad de la herida, se procede a la sutura secundaria, disecando los bordes de la herida y aproximándolos, o a la colocación de un injerto de piel.
Medidas postoperatorias generales
1. Vendaje discretamente compresivo, en la zona donde asienta la herida.
2. Inmovilización del área anatómica afecta.
3. Elevación del miembro, si la herida se localiza en una extremidad, para disminuir el edema.
4. Profilaxis de la infección tetánica.
5. Antibioticoterapia general, corta e intensa, cuando la contaminación de la herida lo aconseje.
Siempre que sea posible, será selectiva (investigación de gérmenes responsables en las heridas infectadas, y valoración de sensibilidad a los distintos antibióticos).
ALGUNOS CONOCIMIENTOS SOBRE METABOLISMO HIDROELECTROLITICO PARA EL CIRUJANO GENERAL
Agua corporal total
El agua comprende el 50% al 70% del peso corporal total. El valor real para individuos sanos es bastante estable y está en función de distintas variables, incluidas la masa de tejidos magros y edad. Las grasas tienen poca agua, de modo que los individuos esbeltos tienen una proporción de agua sobre el peso corporal total mayor que los obesos. El porcentaje de agua es más bajo en mujeres y se correlaciona con su más abundante tejido adiposo subcutáneo.
El agua del cuerpo se divide en tres compartimientos funcionales, el de las células equivale al 30-40% del peso corporal. El extracelular representa otro 20% y se divide entre el líquido intravascular, suero o plasma (5% del peso corporal) y el intersticial, extravascular o extracelular (15 %).
Líquido intracelular
Equivale al 30-40% del peso corporal total.
La composición química del líquido intracelular muestra que el potasio y el magnesio son los cationes principales y los fosfatos y las proteínas son los aniones principales.
Líquido extracelular
El volumen del líquido extracelular equivale al 20% del peso corporal, dividido en dos compartimientos principales, 5% del peso corresponde al volumen plasmático y el 15% restante corresponde al líquido intersticial o extravascular.
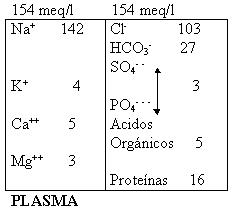
El sodio es el catión principal del líquido extracelular, el cloruro y el bicarbonato los aniones principales. Las diferencias leves en la composición iónica del plasma y del líquido intersticial se derivan principalmente de la concentración de proteínas (aniones orgánicos), más alta en el plasma.
Presión Osmótica
La actividad fisiológica y química de los electrolitos depende de: 1) Número de partículas por unidad de volumen (moles [mol] o milimoles [mmol] por litro); 2) número de cargas eléctricas por unidad de volumen (equivalentes o miliequivalentes litro) y 3) número de partículas osmóticamente activas, o iones, por unidad de volumen (osmoles [Osm] o miliosmoles [mOsm] por litro). El uso de gramos o miligramos por 100 ml, expresa el peso de los electrolitos por unidad de volumen pero no permite la comparación fisiológica de los solutos en una solucion.
Un mol de una sustancia es el peso molecular de la misma en gramos y un milimol es dicha cifra expresada en miligramos. Sin embargo, estos valores no brindan información directa del número de iones osmóticamente activos en la solución ni de sus cargas eléctricas. Los electrolitos de los líquidos corporales se expresan en base a su actividad de combinación química o “equivalentes”. Un equivalente de un ion es su peso atómico en gramos dividido por las valencia, mientras que un miliequivalente (1 meq) es dicha cifra expresada en miligramos. En el caso de iones univalentes 1 meq es igual a 1 mmol. En el de iones divalentes como el calcio y el magnesio, 1 mmol es igual a 2 meq.
Cuando se considera la presión osmótica de una solución, es más descriptivo emplear los osmoles y mimliosmoles. Estos términos se refieren al numero de partículas osmóticamente activas de una solución, aunque no depende de la capacidad de combinación de las sustancias. Así 1 mmol de ClNa, que se disocia casi por completo en sodio y cloruro, aporta 2mOsm, mientras que 1mol de sulfato de sodio (Na2SO4), que se disocia en tres partículas, aporta 3 mOsm. Un mmol de sustancias no ionizadas, como la glucosa, equivale a 1 mOsm de la sustancia.
Las diferencias de composición iónica entre los líquidos intracelular y extracelular se conservan gracias a la membrana plasmática semipermeable. El número total de partículas osmóticamente activas es de 290-310 mOsm en cada compartimiento. La presión osmótica total de un líquido es la suma de las presiones parciales de cada soluto del líquido, pero la presión osmótica efectiva depende de las sustancias que no atraviesan los poros de la membrana semipermeable. Por lo tanto, las proteínas disueltas en el plasma son la causa principal de la presión osmótica efectiva entre los compartimientos plasmático e intersticial. Es frecuente que se denomine presión oncótica coloidal.
INTERCAMBIO NORMAL DE LOS LIQUIDOS Y ELECTROLITOS
Intercambio de agua
El individuo normal consume 2.000-2.500 ml de agua / día; unos 1.500 los ingiere y el resto provienen de alimentos sólidos sea como parte de estos o como un producto de su oxidación. Las pérdidas diarias de agua incluyen 250 ml en las heces 800-1.500 ml en la orina y casi 600 ml. de pérdidas insensibles.
Las pérdidas insensibles de agua ocurren a través de la piel (75%) y pulmones (25%) y aumentan con el metabolismo hiperventilación y fiebre.
Ganancias y pérdidas de sal
En individuos normales, el ingreso diario de sal varía en la escala de 50-90 meq (3-5 g) en la forma de cloruro de sodio. El equilibrio se conserva principalmente por acción de los riñones que excretan el exceso de sal. El sudor es una pérdida de líquido hipotónico con una concentración promedio de sodio de 15 meq/l.
Las pérdidas internas de líquido extracelular en un espacio no funcional como el secuestro de líquido isotónico en una quemadura, peritonitis, ascitis o traumatismos musculares, se denomina cambio de distribución. Esta transferencia o pérdida funcional interna de líquido extracelular puede ser de tipos extracelular (p. ej. peritonitis) intracelulal (V.gr. choque hemorrágico) o mixta como en las quemaduras graves. Sea cual fuere el caso, todos los cambios o pérdidas de distribución originan disminución del espacio de líquido extracelular funcional.
Cambios de volumen
Los déficit o excesos de volumen por lo general se han de diagnosticar mediante el exámen clínico del paciente.
Los valores del nitrógeno de urea sanguínea aumentan con lentitud cuando hay un déficit de liquido extracelular de duración prolongada y magnitud suficiente para reducir la filtración glomerular.
DEFICIT DE VOLUMEN
Los déficit volumétricos extracelulares, son con mucho, el trastorno hídrico más frecuente en pacientes quirúrgicos.
Las pérdidas de líquidos no consisten en agua sola, sino en esta y electrolitos en proporciones casi iguales a las que tienen en el líquido extracelular normal.
Los trastornos que más frecuentemente determinan déficit volumétricos extracelulares abarcan las pérdidas de líquido gastrointestinal por vómito, aspiración nasogástrica, diarrea y drenaje de fístulas. Otras causas habituales son el secuestro de líquido en las lesiones e infecciones de tejidos blandos, inflamaciones retroperitoneales e intrabdominales, peritonitis, oclusión intestinal y quemaduras.
Signos y síntomas del déficit volumétrico extracelular
| Tipos de signos | Moderado | Grave |
| Nerviosos Centrales | Somnolencia Apatía Respuestas lentas Anorexia Interrupción de actividades normales |
Hiporreflexia tendinosa Anestesia distal en las extremidades Estupor Coma |
| Intestinales | Disminución progresiva del ingreso de alimentos | Náuseas y vómitos Rechazo de los alimentos Ileo silencioso y distensión |
| Cardiovasculares | Hipotensión ortostática Taquicardia Venoconstricción Pulso débil |
Lividez cutánea Hipotensión Ruidos cardíacos lejanos o apagados Extremidades frías Ausencia de pulsos periféricos |
| Hísticos | Reblandecimiento y contracción de la lengua Disminución de la turgencia de la piel |
Atonía muscular Ojos hundidos |
| Metabólicos | Hipotermia leve | Hipotermia intensa |
Excesos volumétricos
Pueden ser iatrógenos o secundarios a insuficiencia renal, cirrosis o insuficiencia cardíaca congestiva. Aumentan tanto el volumen plasmático como el intersticial.
En jóvenes sanos, los signos corresponden a la sobrecarga circulatoria. especialmente en la circulación pulmonar.
En ancianos pueden aparecer signos de insuficiencia cardíaca congestiva, con edema pulmonar.
Cambios de concentración
El sodio es el factor principal de la osmolaridad del líquido extracelular.
Hiponatremia
La hiponatremia sintomática aguda, valores menores de 130 meq/l, se caracteriza clínicamente por signos de hipertensión intracraneal y de edema celular excesivo en los tejidos.
La hipertensión quizás sea inducida por la presión intracraneal aumentada, dado que la presión sanguínea se normaliza con la administración de solución salina hipertónica.
Es de importancia especial en pacientes con hiponatremia la aparición de insuficiencia renal oligúrica.
Hipernatremia
Las mucosas están secas y adherentes. La temperatura corporal por lo general aumenta.
Las enfermedades que causan alteraciones agudas significativas de la natremia, por lo general provocan cambios simultáneos del volumen extracelular.
SIGNOS Y SINTOMAS DE LOS CAMBIOS AGUDOS EN LA CONCENTRACION OSMOLAR
| Tipos de signos | Hiponatremia (Intoxicación acuosa) |
Hipernatremia (Déficit acuoso) |
||
| Moderada | Grave | Moderada | Grave | |
| Nerviosos centrales | Calambres musculares Hiperreflexia tendinosa Hipertensión intracraneal (Fase compensada) |
Convulsiones Arreflexia Hipertensión intracraneal (Fase descompensada) |
Inquietud Debilidad |
Delirios Conducta maníaca |
| Cardiovasculares | Cambios de la presión sanguínea y el pulso secundarios a hipertensión intracraneal | Taquicardia Hipotensión (si es grave) |
||
| Hísticos | Salivación, lagrimación y diarrea acuosa La piel conserva la huella digital |
Disminución de la salivación y lagrimación Mucosas secas, adherentes Edema y enrojecimiento linguales Rubor cutáneo |
||
| Renales | Oliguria que progresa a anuria | Oliguria | ||
| Metabólicos | Ninguno | Fiebre | ||
Anormalidades mixtas de volumen y concentración
En ocasiones se presentan personas con riñones normales y déficit volumétrico significativo en quienes hay una insuficiencia renal «funcional».
Conforme progresa el déficit volumétrico, el índice de filtración glomerular cae en forma precipitada y se pierden las funciones renales para la conservación de homeostasia de los líquidos corporales.
Esto puede ocurrir con déficit volumétricos leves en ancianos con disfunción renal subclínica en quienes el nitrógeno de la urea sanguínea suele aumentar a más de 100 mg/ 100 ml en respuesta al déficit volumétrico con aumento simultáneo de la creatininemia.
Estos cambios suelen ser reversibles con la corrección pronta del déficit volumétrico extracelular.
CAMBIOS DE COMPOSICION
Equilibrio ácido-básico
El pH (o sea el logaritmo negativo de la concentración de hidrogeniones) de los líquidos corporales se conserva normalmente dentro de una estrecha escala a pesar de la gran carga de ácidos que se generan como producto secundario del metabolismo.
Diversos sistemas amortiguadores neutralizan de manera eficaz a los ácidos que después se excretan por pulmones y riñones.
Entre los amortiguadores importantes se incluyen los fosfatos y proteínas que tienen funciones primordiales en la conservación del pH intracelular así como el sistema de bicarbonato – ácido carbónico, que funciona principalmenlte en el medio extracelular.
La hemoglobina influye de manera primordial como amortiguador intracelular en los eritrocitos.
Un sistema amortiguador consiste en un ácido o base débiles y sus sales. El efecto amortiguador resulta de la formación de una cantidad de ácido o base débil equivalente a la de ácido o base fuertes que se agregan al sistema. El cambio resultante del pH es considerablemente menor que si la sustancia se añadiera al agua sola. De esta manera ácidos inorgánicos (p.ej., clorhídrico sulfúrico o fosfórico) y orgánicos (v.gr. láctico pirúvico, ácidos cetónicos) se combinan con la base bicarbonato y se produce la sal sódica del ácido así como ácido carbónico.
HCl + NaHCO3 NaHCl + H2CO3
El ácido carbónico formado se excreta después por los pulmones como CO2. Los aniones de ácidos inorgánicos se excretan por vía renal con hidrógeno o como sales de amoníaco. Los de ácidos orgánicos por lo general se metabolizan cuando se corrige el trastorno causal, aunque es factible su excreción renal cuando sus concentraciones son altas.
Acidosis respiratoria
Se relaciona con retención de CO2 secundaria a disminución de la ventilación alveolar, son sus causas más frecuentes: depresión del centro respiratorio, neumopatías y se compensa por retención renal de bicarbonatos, excreción de sales de ácidos y aumento de la formación de amoníaco.
Alcalosis respiratoria
Sus causas son:
Hiperventilación por aprensión o dolor, compensación de una hipoxia, lesiones del sistema nervioso central y ventilación mecánica. Cualquiera de estos factores puede causar disminuciones rápidas de la PCO2 arterial y aumentos también rápidos del pH sérico.
Aunque la concentración sérica de bicarbonato es normal en la fase aguda, cae con la compensación si persiste el trastorno.
Puede surgir alcalosis respiratoria cuando se intenta aumentar la PO2 en hipóxicos. El tratamiento apropiado de pacientes con ventilación mecánica requiere medir con frecuencia los gases sanguíneos (oxicapnógrafo) y ajustar el ventilador. No se ha de permitir que la PCO2 arterial caiga por debajo de 30 mmHg, sobre todo en presencia de hipocaliemia previa o digitalización pues se pueden producir arritmias y fibrilación ventricular.
El tratamienlto es ante todo preventivo, con uso apropiado de la ventilación mecánica y corrección del déficit de K+ preexistente.
Acidosis metabólica
Se deriva de la retención o ganancia de ácidos fijos (en cetoacidosis diabética, acidosis láctica o azoemia) o perdida de bases bicarbonato (diarrea, fístulas del intestino delgado o insuficiencia renal con incapacidad para la reabsorción de bicarbonato). El exceso de H+ hace que disminuyan el pH y la concentración de bicarbonato sérico.
La compensación inicial es pulmonar, con aumento de la frecuencia y profundidad respiratorias y depresión de la PCO2 arterial.
Las lesiones renales pueden obstaculizar la importante función de regulación del equilibrio acidobásico. Estos órganos tienen funciones vitales en este aspecto gracias a la excreción de los productos de deshecho nitrogenados y metabolitos ácidos, así como la reabsorción de bicarbonato.
Si los riñones están sanos, la acidosis metabólica es factible cuando se ve rebasada la capacidad de los mismos para excretar una gran carga de Cl. Esto es particularmente frecuente en sujetos con pérdidas excesivas de líquidos gastrointestinales alcalinos (secreciones biliares, pancreáticas y del intestino delgado) y reciben soluciones parenterales durante periodos prolongados. La reposición continua de estas pérdidas con soluciones que tienen una proporción inadecuada de Cl/bicarbonato, solución salina isotónica, no corrige el cambio del pH, está indicado el uso de una solución salina equilibrada, como la de Ringer con lactato.
Una de las causas más frecuentes de acidosis metabólica grave en pacientes quirúrgicos es la insuficiencia circulatoria con acumulación de ácido láctico. Esto es reflejo de la hipoxia de los tejidos por riego sanguíneo deficiente.
El choque hemorrágico agudo suele provocar caída rápida y considerable del pH. Después de la restauración del riego sanguíneo hístico adecuado mediante reposición volumétrica apropiada, el ácido láctico se metaboliza con rapidez y el pH se normaliza.
El uso de la solución de Ringer con lactato para reponer el déficit volumétrico extracelular derivado de choque hemorrágico, asociando la administración de la solución con transfusiones, no acentúa la acidosis láctica. En vez de ello, disminuye la lactacidemia y el pH se normaliza, ambas cosas con rapidez, lo que no ocurrre cuando se emplea sangre sola.
La administración indiscriminada de NaHCO3 durante la reanimación en pacientes en choque hipovolémico no se aconseja, pues la alcalosis metabólica leve es frecuente después de la reanimación.
Alcalosis metabólica
Surge como la pérdida de ácidos o la ganancia de bicarbonato y se agrava con la depleción preexistente de K+. Tanto el pH como la concentración plasmática de bicarbonato son altas. La compensación de la afección es principalmente renal, dado que la compensación respiratoria es mínima.
La mayoría de los pacientes con alcalosis metabólica tiene cierto grado de hipocaliemia, debida en parte a la entrada de K+ en las células conforme sale H+ hacia el suero. Los riesgos de la alcalosis metabólica son los ya analizados para la alcalosis respiratoria.
Un problema frecuente en el posoperatorio es la alcalosis metabólica con hipocloremia e hipocaliema, que resulta del vómito persistente o la aspiración gástrica en pacientes con obstrucción pilórica. A diferencia del vómito con el píloro permeable, que incluye una pérdida combinada de secreciones gástricas, pancreáticas, biliares e intestinales, aquella entidad clínica resulta en la pérdida de líquido con contenidos altos de Cl– e H+ con relación al Na+. En el comienzo, la excreción urinaria de bicarbonato aumenta para compensar la alcalosis. Esto resulta de la reabsorción de H+ en los túbulos renales, con la excreción acompañante de K+. Al progresar el déficit volumétrico, hay reabsorción de Na+ mediada por aldosterona, con excreción de K+. La hipocaliema consecuente origina excreción de H+ en lugar de K+ por este mecanismo, lo que produce aciduria paradójica. El resultado es alcalosis con hipocaliemia que se perpetúan. El tratamiento correcto incluye la reposición del déficit volumétrico extracelular con solución salina hipotónica, además de la administración de K+ . La reposición volumétrica y la diuresis adecuada son necesarias antes de administrar el K+.
ANORMALIDADES DEL POTASIO
El ingreso normal de potasio en la dieta es de 50/100 meq/día y la mayor parte de este ingreso se excreta por orina. Casi el 98% del potasio corporal se encuentra en el compartimiento intracelular, con una concentración cercana a los 150 meq/l, lo que hace que sea el principal catión del agua intracelular.
Cantidades significativas de K+ intracelular pasan al medio extracelular, como respuesta a las lesiones graves, el stress quirúrgico, acidosis y estados catabólicos. El aumento significativo de la caliemia puede surgir en tales estados si hay insuficiencia renal, aunque la hipercaliemia riesgosa (mayor que 6 meq/l) es rara si la función renal es normal.
Hipercaliemia
Los síntomas gastrointestinales incluyen náusea, vómito, cólico intestinal intermitente y diarrea.
Los cardiovasculares son evidentes en el ECG, con ondas T altas y puntiagudas, ensanchamiento del complejo QRS y depresión del segmento ST. La desaparición de las ondas T, el bloqueo cardíaco y el paro cardíaco diastólico suelen ocurrir con los valores crecientes de polasio.
Tratamiento:
Supresión de la administración, supresión de la causa, adlministración IV de 1g de gluconato de calcio al 10%, con vigilancia electrocardiográfica.
También se puede administrar HCO3 y glucosa con insulina. (45 meq de NaHCO3 en 1000 ml de dextrosa al 10% en agua con 20 unidades de insulina corriente).
El tratamiento definitivo de la hipercaliemia requiere administración entérica de resinas de intercambios de cationes o diálisis.
Hipocaliemia
El problerna más frecuente en pacientes quirúrgicos es la hipocaliemia, que puede surgir por:
1) Excreción renal excesiva de potasio
2) Paso del elemento a las células
3) Administración prolongada de soluciones parenterales sin potasio, con continuación de las pérdidas renales obligatorias del elemento (de 20 meq/día o más)
4) Hiperalimentación parenteral total con reposición deficiente de K+.
5) Pérdida en las secreciones gastrointestinales
El aumento de la excreción renal de K+ ocurre con la alcalosis respiratoria y metabólica, este elemento compite con los hidrogeniones por la excreción en los túbulos renales a cambio de Na+. De tal manera en la alcalosis el aumento de la excreción de K+ en lugar de Na+, permite la consevación de H+.
La hipocaliemia misma suele producir alcalosis metabólica, dado que el aumento de la excreción de H+ ocurre cuando baja la concentración de K+ en las células de los túbulos renales.
La excreción de K+ por los túbulos renales aumenta cuando hay grandes cantidades de Na+ para excreción, de aquí que las necesidades de K+ aumentan con la reposición volumétrica isotónica masiva o de duración prolongada.
La concentración promedio de potasio en los fluidos gastrointestinales es relativamente baja, aunque surge hipocaliemia significativa si se administran soluciones sin K+ con fines de reposición.
En pacientes que reciben nutrición IV se requieren grandes cantidades de complemento de K+ para restaurar las reservas intracelulares disminuidas y satisfacer las necesidades de síntesis en los tejidos durante la fase anabólica. Los signos de la hipocaliemia son: contractilidad deficiente de los músculos estriados, liso y cardíaco.
Debilidad que suele progresar a la parálisis fláccida, hiporreflexia o arreflexia tendinosa e ileo paralítico.
Es característica la sensibilidad a la digital, con arritmias cardíacas y signos ECG de bajo voltaje, aplanamiento de las ondas T y depresión del segmento ST.
Los signos de hipocaliemia suelen quedar opacados por los del déficit volumétrico extracelular grave. La reposición de este último tiende a agravar la situación, ya que disminuye más la caliemia por la hemodilución.
El tratamiento de la hipocaliemia consiste principalmente en su prevención y en la reposición de líquidos adecuada.
No se deben agregar más de 40 meq/l de solución IV.
La velocidad de administración no debe ser mayor de 40 meq/h.
Debe haber monitoreo ECG.
En ausencia de indicaciones específicas, el K+ no se administra en pacientes oligúricos ni durante las primeras 24 hs después de traumatismos o stress quirúrgicos importantes.
ANORMALIDADES DEL CALCIO
La mayor parte de los 1000-1200 gr. de calcio corporal en adultos se localiza en los huesos como fosfato y carbonato.
El ingreso diario normal de calcio es de 1-3 gr.
Una gran proporción se excreta por vía digestiva y 200 mg o menos diarios, en la orina.
La calcemia normal es de 8,5-10,5 mg/100 ml, y casi la mitad no está ionizada, sino unida a las proteínas plasmáticas. Una fracción no ionizada adicional (del 5% ) se combina con otras sustancias en el plasma y líquido intersticial, mientras que el 45% restante es la porción ionizada, de la que depende la función neuromuscular. Por lo tanto la medición de la proteinemia es indispensable para el análisis correcto de la calcemia. La razón de calcio ionizado sobre el no ionizado también se relaciona con el pH, la acidosis hace que aumente la fracción ionizada, mientras la alcalosis la disminuye.
HIPOCALCEMIA
Los síntomas de la hipocalcemia pueden surgir con valores que no llegan a 8 mg/100 ml y abarcan: Entumecimiento y hormigueo circunbucal y de las puntas de dedos de manos y pies.
Los signos que son de origen neuromuscular abarcan; hiperreflexia tendinosa signo de Chvostek, calambres musculares y cólicos abdominales, tetania con espasmo carpopedal, convulsiones, prolongación del intervalo QT en el electrocardiograma.
Las causas más frecuentes son:
La pancreatitis aguda
Infecciones masivas de tejidos blandos (fascitis necrosante)
Insuficiencias renales crónica y aguda
Fístulas pancreáticas y del intestino delgado
Hipoparatiroidismo
Los iones del calcio también suelen disminuir con las depleciones graves de magnesio.
El tratamiento
Corrección de la causa y reposición simultánea del déficit.
Los síntomas agudos se suelen aliviar con la administración IV de gluconato o cloruro de calcio.
El lactato de calcio se administra por vía oral con o sin complementos de vitamina D, a pacientes en que se precisa reposición prolongada.
La mayoría de los pacientes que reciben transfusiones no requieren complemento de calcio.
La unión del calcio ionizado con citrato por lo general se compensa gracias a la movilización de calcio de las reservas corporales.
Sin embargo, en pacientes que reciben 500 ml de sangre en 5-10 minutos, se recomienda la administración de una dosis apropiada de 0,2 g de CaCl (2 ml de solución de cloruro de calcio) al 10% administrada por vía IV con un catéter separado por cada 500 ml de sangre transfundida.
HIPERCALCEMIA
Los síntomas de la hipercalcemia son más bien vagos, de origen gastrointestinal, renal, musculosquelético y del SNC.
Las manifestaciones tempranas de la hipercalcemia incluyen fatigabilidad, laxitud, debilidad de grado variable, anorexia, náusea, vómitos y disminución ponderal.
Con valores más altos, se presenta sonambulismo, estupor y por último coma.
Otros síntomas son: cefalea intensa, dolores de espalda y extremidades, sed, polidipsia y poliuria.
Las dos causas principales de hipercalcemia son el hiperparatiroidismo y los cánceres con metástasis en huesos.
Terapéutica
La corrección rápida del déficit volumétrico extracelular acompañante reduce con prontitud la calcemia por dilución y por aumento de la depuración renal, esto último es susceptible de intensificación con la furosemida. Otras medidas que arrojan beneficios transitorios son la administración de calcitonina, mitramicina, esteroides o hemodiálisis.
El tratamiento definitivo de las crisis hipercalcémicas en pacientes con hiperparatiroidismo es la operación.
En sujetos con metástasis, para el tratamiento de la hipercalcemia se prescribe una dieta baja en calcio y se toman las medidas para garantizar la hidratación adecuada.
ANORMALIDADES DEL MAGNESIO
El contenido corporal total de magnesio en adultos es de casi 2.000 meq, de los que casi la mitad está en los huesos y se libera con lentitud.
Su porción principal es intracelular.
La magnesemia está en la escala de 1,5-2,5 meq/L.
El ingreso dietético normal de magnesio es de cerca de 20 meq (240 mg) diarios.
Se excreta principalmente en las heces, y el resto en la orina. Los riñones tienen capacidad considerable para conservar el magnesio; cuando no se ingiere este.
DEFICIT DE MAGNESIO
Ocurre con el ayuno, síndromes de malabsorción, pérdidas crónicas de líquidos gastrointestinales y fluidoterapia IV prolongada con soluciones sin magnesio, así como durante la nutrición parenteral total cuando se agregan cantidades insuficientes del elemento a las soluciones. Otras causas son: la pancreatitis aguda, tratamiento de la cetoacidosis diabética, hiperaldosteronismo primario, alcoholismo crónico, administración de anfotericina B y curso clínico prolongado de las lesiones térmicas.
La depleción del ion magnesio se caracteriza por hiperactividad neuromuscular y del sistema nervioso central. Los signos y síntomas son muy similares a los de la hipocalcemia.
El tratamiento de la hipomagnesemia es la administración parenteral de soluciones de sulfato o cloruro de magnesio. Si hay normofunción renal se pueden prescribir hasta 2 meq/Kg./día por vía IV.
Se administran 10 a 20 meq. diarios de solución de sulfato de magnesio al 50% por vía IV, la inyección IM del magnesio es dolorosa.
El Mg++ no se debe prescribir en pacientes oligúricos o con déficit volumétricos graves.
Exceso de magnesio
El aumento en la magnesemia ocurre cuando el índice de filtración glomerular cae por debajo de 30 ml/hora.
Los signos abarcan letargia y debilidad, con disminución progresiva de los reflejos tendinosos, problemas de conducción cardíaca y cambios en el ECG (ampliación del intervalo PR, ensanchamiento del complejo QRS y elevación de la onda T) se asemejan a los observados en la hipercaliemia. Somnolencia y parálisis muscular ocurre en etapas tardías pudiendo llegar al coma y a la muerte.
El tratamiento consiste en reducir la magnesemia mediante corrección de la acidosis coexistente.
TRATAMIENTO HIDROELECTROLITICO
Corrección de cambios de volumen
Los déficit volumétricos en pacientes quirúrgicos se suelen derivar de la pérdida de líquidos que pasan al medio externo o de la redistribución interna del líquido extracelular en un compartimiento no funcional.
La redistribución interna, el concepto del «tercer espacio» se considera en relación a pacientes con ascitis, quemaduras, lesiones por aplastamiento, lesiones inflamatorias de los órganos intrabdominales (peritoneo, pared intestinal, secreción de líquidos a la luz intestinal, otros tejidos), infecciones masivas de tejidos subcutáneos (fascitis necrosante).
El adjetivo «no funcional» se emplea porque el líquido ya no participa en las funciones normales del compartimiento extracelular.
El déficit se calcula de manera aproximada con base en la gravedad de los signos clínicos, el leve equivale a pérdida de casi 4% del peso corporal; el moderado de 6-8 y el grave, a 10%.
La reposición hídrica
Se emplean como normas generales la reversión de los signos del déficit volumétrico, combinada con la estabilización de la presión sanguínea y pulso, además de diuresis de 30-50 ml/h.
La administración excesiva de glucosa (más de 50 g/ 2-3 hs) tiende a provocar diuresis osmótica.
Velocidad de administración de las soluciones
Varía según gravedad y tipo de trastorno hídrico, presencia de pérdidas continuas y estado cardíaco.
Los déficit volumétricos más graves se reponen sin riesgos en la fase inicial con soluciones isotónicas a velocidades de hasta 2.000 ml/h, que se disminuyen conforme mejora el estado de hidratación.
Los trastornos cardiovasculares acompañantes requieren vigilancia cardiovascular constante. Se suelen precisar mediciones de las presiones de llenado centrales y del gasto cardíaco.
Corrección de los cambios de concentración
La solución salina al 5% o la molar de lactato de sodio se emplean para la corrección inmediata de la hiponatremia grave.
El déficit de sodio puede calcularse multiplicando la disminución de la natremia por debajo de lo normal (en meq/l) por los litros de agua corporal total.
Debe haber una evaluación clínica y química antes de continuar la administración de soluciones salinas.
La corrección ulterior se facilita con la restauración de la función renal. gracias a la corrección del déficit de volumen.
En pacientes cuya reserva cardíaca está limitada se recomienda administrar dosis pequeñas de solución salina hipertónica, con evaluación de respuesta clínica y natremia.
El tratamiento de la hiponatremia acompañada de exceso de volumen consiste en la restricción del ingreso de agua. En pacientes con reserva cardíaca limitada puede estar indicada la diálisis.
La corrección de la hipernatremia sintomática grave, con déficit volumétrico acompañante, suele consistir en la administración lenta de solución de dextrosa al 5% en agua.
Consideraciones diversas
La corrección del déficit de potasio debe comenzar después de lograr diuresis adecuada, en especial si hay alcalosis metabólica.
Se debe en lo posible corregir las anemias en el preoperatorio.
El hematocrito aumenta casi un 3% después de la administración de una unidad de paquete globular a adultos de peso normal.
Fluidoterapia transoperatoria
Cuando la reposición preoperatoria del líquido extracelular ha sido incompleta, la hipotensión puede surgir con prontitud al inducir la anestesia. Este problema se previene al satisfacer las necesidades de base y reponer las pérdidas hidroelectrolíticas anormales, por tratamiento IV en el preoperatorio.
La sangre perdida durante la operación se ha de reponer.
Es usual que no sea necesario reponer pérdidas menores de 500 ml.
Además de las pérdidas de sangre transoperatorias, hay otras de líquido extracelular durante la cirugía mayor. Algunas de estas, incluido el edema por disección extensa, acumulación del líquido en la luz y pared del intestino delgado, y acumulación del líquido en la cavidad peritoneal, son clínicamente identificables y están bien reconocidas. Se consideran cambios de distribución, ya que disminuyen el volumen funcional del líquido extracelular.
La corrección transoperatoria del déficit de volumen con solución salina disminuye de modo considerable la oliguria postoperatoria y se considera un complemento o coadyuvante fisiológico de la reposición de las pérdidas por secuestro.
Pautas clínicamente útiles
1) La sangre se repone conforme se pierda, sin importar el tratamiento hidroelectrolítico adicional
2) La reposición del líquido extracelular que se pierde durante la operación, comienza en el transoperatorio
3) Aunque el volumen de solución salina necesario durante la operación es de 0,5 a 1 L/h, no debe ser mayor de 2 a 3 L, durante la cirugía abdominal mayor con duración aproximada de 4 hs, a menos que haya otras pérdidas mensurables.
Fluidoterapia postoperatoria
Postoperatorio inmediato
Las órdenes de soluciones postoperatorias se escriben cuando el paciente está en la sala de recuperación y se ha valorado su estado hídrico, lo que comprende la valoración del estado hídrico en el preoperatorio, el volumen de pérdidas y ganancias de líquidos durante la operación y el examen clínico del paciente, con valoración de los signos vitales y diuresis.
Las órdenes iniciales se redactan de manera que se corrija todo déficit existente, seguido esto de fluidoterapia de sostén durante el resto del día.
Es frecuente que se calculen también las necesidades de las 24 hs siguientes.
En el posoperatorio inmediato, la depleción del líquido extracelular puede resultar de pérdidas continuas en el sitio de lesión o de traumatismo quirúrgico.
Los déficit no identificados del líquido extracelular en el postoperatorio inmediato se manifiestan ante todo con inestabilidad circulatoria.
La hipotensión y taquicardia requieren investigación pronta, seguida de tratamiento apropiado. Los valores generalmente aceptados de 90/60 para la presión sanguínea y pulso menor de 120 en el postoperatorio no suelen bastar para prevenir la isquemia renal, a menos que la diuresis sea adecuada y no haya signos de choque. Se suele recomendar la valoración del nivel de conciencia, diámetro y reactividad pupilar, permeabilidad de las vías respiratorias, características de las respiraciones, temperatura y color de la piel, temperatura corporal y diuresis de 30-50 ml/h, así como la valoración crítica de la operación y de la fluidoterapia transoperatoria. En pacientes con inestabilidad circulatoria, el problema a menudo cede, por medio de la reposición volumétrica con 1000 ml adicionales de solución salina normal, mientras se determina si hay pérdidas que se continúan u otras causas. Es innecesario y probablemente desaconsejable administrar potasio durante las primeras 24 hs del postoperatorio, a menos que haya déficit corroborado.
POSTOPERATORIO MEDIATO
La reposición de volumen durante la fase de convalescencia postoperatoria debe contemplar la medición y reposición precisas de todas las pérdidas. Esto incluye la reposición de las pérdidas sensibles medidas, por lo general de origen gastrointestinal, así como la estimación y reposición de pérdidas insensibles.
Las pérdidas insensibles suelen ser relativamente constantes y promedian 600 ml/día. Esto suele aumentar con el hipermetabolismo, hiperventilación y fiebre, hasta un máximo de casi 1.500 ml/día. Las pérdidas insensibles estimadas se reponen con dextrosa al 5% en agua.
Casi 1 L de líquidos se ha de administrar a fin de reponer el volumen de orina, tal reposición puede consistir en dextrosa al 5% en agua, dado que los riñones conservan el sodio, es posible administrar un pequeño volumen de solución salina adicional.
En ancianos con riñones que tienden a perder sal y pacientes con lesiones craneoencefálicas, puede surgir hiponatremia insidiosa. La medición de la natriuria facilita la reposición adecuada.
Las pérdidas gastrointestinales se reponen con solución salina isotónica
El volumen del sudor no suele ocasionar problemas, salvo en pacientes febriles, cuyas pérdidas pueden ser mayores de 250 ml por grado de fiebre.
La reposición parenteral prolongada requiere la valoración frecuente del ionograma sérico.
La cantidad de potasio repuesto es de 40 meq/día para compensar su excreción renal, además de 20 meq/l para reponer las pérdidas gastrointestinales.
La reposición deficiente suele prolongar el ileo paralítico usual en el postoperatorio y contribuir a la aparición insidiosa de alcalosis metabólica.
Consideraciones especiales en el postoperatorio
Excesos de volumen. La administración de solución salina en exceso, puede dar por resultado la sobreexpansión del fluido extracelular. Por lo tanto es importante determinar con la mayor precisión posible, a partir de los datos de ingreso, egreso y natremia, las necesidades reales.
El primer signo es de aumento ponderal durante el período catabólico, en que el paciente pierde 250-500 g/día. La pesadez de ojos, la ronquera o disnea con los movimientos, así como el edema periférico.
Los signos circulatorios y pulmonares de la sobrecarga pueden surgir en forma tardía y corresponder a sobrecarga masiva.
HIPONATREMIA
Es infrecuente si en la fluidoterapia transoperatoria se incluyen volúmenes adecuados de solción salina isotónica.
La hiponatremia puede surgir con facilidad cuando se administra agua para reponer perdidas de líquidos que contienen sodio o si el ingreso de agua en forma invariable es mayor que sus pérdidas. Esto último puede ocurrir con la oliguria.
Es dificil que surja hiponatremia grave si hay normofunción renal.
Cada 100 mg/100 ml de aumento de la glucemia por arriba de lo normal origina caída de la natremia de 1,6-3 meq/litro.
Liberación de agua endógena. Los pacientes que reciben soluciones IV sin ingreso calórico adecuado presentan, entre el quinto y décimo día, ganancias significativas de agua (máximo de 500 ml/ día) por catabolismo celular excesivo, con lo que disminuye la cantidad de agua exógena que requieren cada día.
Paso de agua al medio intracelular. La sepsis bacteriana generalizada con frecuencia se acompaña de caídas repentinas de la natremia.
HIPERNATREMlA.
La hipernatremia, a diferencia de la hiponatremia, surge incluso con normofunción renal. La hiperosmolaridad del líquido extracelular resulta en el paso de agua del medio intracelular al extracelular, situación en que la hipernatremia suele indicar déficit significativos del agua corporal total.
Clasificación
Pérdidas extrarrenales excesivas de agua.
Las pérdidas por evaporación del sudor pueden llegar a varios litros diarios con el aumento del metabolismo por cualquier causa: fiebre, traqueostomía en entornos secos, pueden perder hasta 1 – 1,5 L/día.
El incremento de tal evaporación en las superficies del tejido de granulación es con frecuencia de magnitud significativa en pacientes con lesiones térmicas, con perdidas que llegan a 3,5 L/día.
Aumento de las perdidas renales de agua. Las lesiones hipóxicas de los túbulos distales y colectores o la pérdida de la estimulación secretora de la ADH por lesiones del SNC pueden originar la excreción de grandes volúmenes de orina con pocos solutos. En ambos casos, disminuye la reabsorción facultativa de agua.
Cargas de solutos. El ingreso alto de proteínas suele producir el aumento de la carga osmótica de urea, lo que hace inevitable la excreción de grandes volúmenes de agua. Después surgen hipernatremia, azoemia y déficit del volumen extracelular.
INSUFICIENCIA RENAL DE ALTO GASTO. La insuficiencia renal aguda subsecuente a traumatismos accidentales o quirúrgicos es una complicación con mortalidad considerable. Su diagnóstico se basa en la oliguria persistente y los datos químicos de uremia.
El curso clínico se caracteriza por oliguria que dura varios días a varias semanas, seguida de caída progresiva de la diuresis diaria hasta que se restauran las funciones excretora y concentradora de los riñones.
La uremia, que surge sin un período de oliguria y se acompaña de diuresis mayor de 1000-1500 ml/día, es una entidad más frecuente pero poco reconocida. Los datos clínicos y de estudios de laboratorio hacen suponer que la insuficiencia renal de alto gasto es la respuesta de los riñones a episodios de lesiones menos graves.
Tratamiento
La solución salina se suele administrar con lactato para controlar la acidosis metabólica leve que sobreviene.
El riesgo principal en la insuficiencia renal de alto gasto consiste en no diagnosticarla a causa de la poliuria. La administración incorrecta de potasio IV en tal cuadro puede originar hipercaliemia.
El curso habitual de la insuficiencia renal de alto gasto comienza con un período de oliguria. La diuresis es normal o excesiva, con frecuencia de 3-5 l/día, mientras que también aumentan los valores de nitrógeno de la urea sanguínea, que se continúa durante 8-12 días antes de descender.
Archivo basado en la 5ª edición de “Principios de Cirugía General” de Schwartz, Shires y Spencer
Dr. Anatole Bender