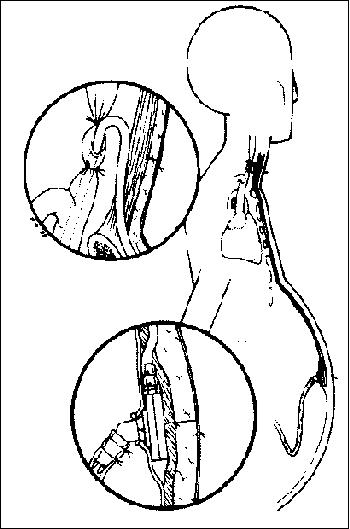
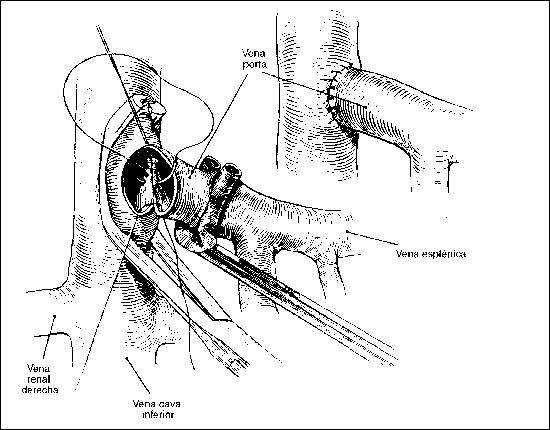
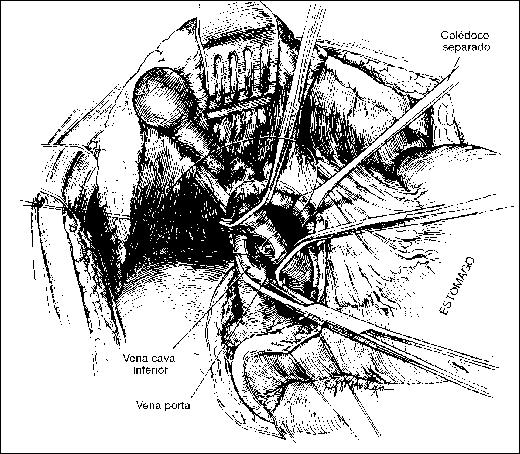
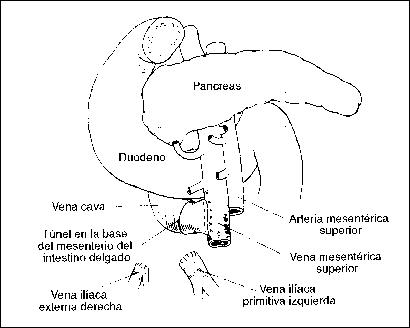
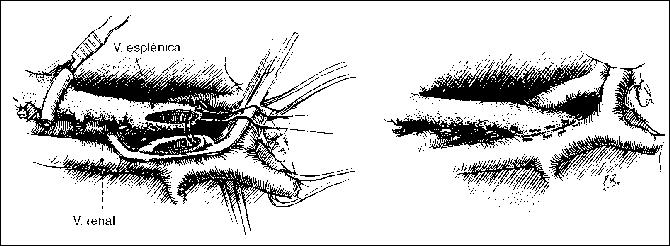
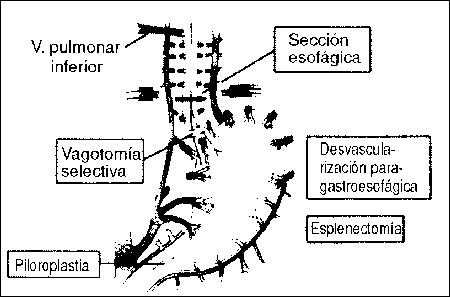
PANCREATITIS AGUDA
La pancreatitis aguda es un proceso inflamatorio relativamente común.
Síntomas
Varían desde un dolor abdominal localizado y leve hasta el abdomen agudo con shock.Se presenta como brote aislado o recurrente (recidivas) Puede haber secuelas como: diabetes, esteatorrea, calcificaciones, etc.
Etiología
Las causas más frecuentes son el alcoholismo crónico y la litiasis biliar. Se invocan causales como fármacos, pero solo existen pruebas de tal implicación en el caso de tiacidas, azatioprina y sulfonilureas La hipertrigliceridemia hereditaria puede causar dolores abdominales, pero es más frecuente que la hiperlipemia aparezca como resultado de la propia pancreatitis En el post-operatorio pueden aparecer formas de pancreatitis graves, incluso en casos de cirugía extraabdominal. Los traumatismos y la colangiografía endoscópica retrógrada, también son desencadenantes relativamente frecuentes. Factores etiológicos menos frecuentes: Víricas, ulcera péptica complicada, vasculitis isquemia, cáncer de páncreas, fibrosis quística, pancreatitis hereditaria y anomalías anatómicas del esfinter de Oddi
Fisiopatología y anatomía patológica
Autodigestión por enzimas activadas. Sustancias como la tripsina, lipasa, fosfolipasa y elastasa, los ácidos biliares no conjugados y diversos agentes vasoactivos,tales como calicreina, pueden ser los causantes de los cambios patológicos observados: edema, hemorragia y necrosis grasa y parenquimatosa. El mecanismo propuesto para explicar la activación de la tripsina es el reflujo hacia los principales conductos pancreáticos de jugo duodenal y bilis.
MANIFESTACIONES CLINICAS
Desde el dolor abdominal ligero, hasta el dolor intenso, shock profundo y coma. Se presentan en pacientes con antecedentes de alcoholismo o patología biliar, que desarrollan dolor abdominal asociado con náuseas y vómitos El dolor puede ser agudo o insidioso, constante, localizado en epigastrio, también puede generalizarse y ser más intenso en las areas subcostal o retroesternal; en el 50 % de los pacientes se irradia a la espalda. El comienzo del dolor se relaciona a menudo con la ingesta de alcohol o comidas copiosas. Es típico que el dolor disminuya cuando el paciente se echa hacia adelante o adopta la posición fetal. En ocasiones el paciente presenta ileo y shock. En 75 % de los casos hay náuseas y vómitos. Hematemesis, melena y diarrea son síntomas poco frecuentes
EXPLORACION FISICA: Aspecto de enfermedad grave, inquieto, presenta dolorimiento abdominal, rigidez muscular, distensión y ruidos intestinales escasos o ausentes. Febrícula, taquicardia e hipotensión, así como una ascitis de poco volumen. Fiebre elevada: puede ser por colangitis, infección asociada o absceso pancreático. Trastornos pulmonares: taquipnea y disnea. A la auscultación signos de atelectasia, neumonitis y/o derrame pleural. A los 5 o 10 días se puede palpar una masa abdominal que corresponde a flemón, seudoquiste o absceso. Otros signos físicos que pueden aparecer, son: Ictericia, xantomas y signo de Chvostek, nódulos subcutaneos de necrosis grasa y hematomas en flancos o región umbilical que han sido descriptos por Grey Turner y Cullen.
DIAGNOSTICO
Historia clínica detallada, exploración física, pruebas radiológicas y de laboratorio
Laboratorio
Dosaje de amilasa sérica: procede fundamentalmente del páncreas y de las glándulas salivales, se elimina por riñón. En la pancreatitis aguda se detecta hiperamilasemia poco después del comienzo, se recuperan los valores normales en 1 a 4 días, la persistencia de amilasemia elevada, sugiere complicación o cáncer o fuente extrapancreática. El grado de elevación de amilasa no guarda relación con la gravedad de la pancreatitis La hiperamilasemia puede aparecer asociada a colecistitis, cetoacidosis diabética, insuficiencia renal, procesos salivales, obstrucción, perforación o isquemia intestinal, aneurisma aórtico disecante y diversos procesos ginecológicos Lipasa sérica y amilasa urinaria pueden mantenerse elevadas mucho más tiempo que amilasemia. Las elevaciones significativas de amilasa en líquido pleural o peritoneal son útiles para el diagnóstico. Leucocitosis, hiperglucemia transitoria, anemia, pruebas de función hepática anormales e hipertrigliceridemia, es frecuente la hipocalcemia
DIAGNOSTICO POR IMAGENES
Ileo generalizado o localizado en yeyuno (asa centinela), o colon (obstrucción de colon «cut-off»), desplazamiento del estómago o del duodeno, calcificaciones pancreáticas, cálculos biliares; se debe investigar la presencia de aire subdiafragmático para descartar la perforación visceral. Radiografía de tórax: elevación diafragmática, atelectasia, neumonitis, derrame pleural. Ecografía y T.A.C. permiten visualizar el páncreas en la mayoría de los pacientes, siendo especialmente útiles para detectar complicaciones o patología biliar asociada. La T.A.C. helicoidal y la ultrasonografía endoscópica (U.E.), son un ejemplo del avance en imagenología. La pancreatografía retrógrada endoscópica estaría contraindicada, haciendo la salvedad del caso en que se conoce la etiología biliar de la pancreatitis por ecografía, en que se detecta un cálculo enclavado en la papila y que pudiera ser resuelta la patología por una papilotomía transduodenal.
DIAGNOSTICO DIFERENCIAL
Colecistitis aguda
Ulcera péptica
Perforación
Oclusión intestinal
Enfermedades ginecológicas agudas (embarazo ectópico, ruptura de quistes de ovario)
PRONOSTICO La tasa de mortalidad en el brote único de pancreatitis es de alrededor del 10 % Las pancreatitis debidas a patología biliar y las que aparecen en el período post-operatorio son las que presentan morbilidad y mortalidad más elevadas. También tiene valor pronóstico la gravedad del episodio inicial. Se han establecido una serie de indicadores de la gravedad de la enfermedad, basados en datos clínicos y de laboratorio. Cuando se presentan 3 o más de estos datos dentro de las 48 Hs. siguientes al comienzo del proceso, el pronóstico es malo, pudiendo ser fatal el desenlace.
FACTORES QUE INDICAN UN PRONOSTICO MALO DE LA PANCREATITIS AGUDA
MOMENTO DEL INGRESO
Edad > 55 años
Leucocitos > 16.000 / mm3
Glucosa > 200 mg/ 100 ml
LDH > 350 UI / L
GOT > 250 U Frankel %
PRIMERAS 48 HORAS
Disminución del Hto. > 10 %
Aumento del BUN > 5% por mg /100 ml
Ca < 8 mg / 100 ml
PO2 arterial < 60 mm Hg
Déficit de bases > 4 meq / l
Estimación de líquido secuestrado > 6 L
(De Ranson y Col. Surg. Gynecol Obstet. 143: 209, 1976)
Otro esquema de clasificación de las pancreatitis agudas, es el de Balthazar, que también lo hace con el fin de poder establecer un pronóstico, utilizando parámetros tomográficos
CLASIFICACION TOMOGRAFICA PRONOSTICA DE LA PANCREATITIS AGUDA
BALTHAZAR
GRADO A: NORMAL
GRADO B: AGRANDAMIENTO FOCAL O DIFUSO PARENQUIMA NO HOMOGENEO PEQUEÑA COLECCION LIQUIDA INTRAPANCREATICA
GRADO C: IGUAL A GRADO B MAS: CAMBIOS INFLAMATORIOS PERIPANCREATICOS NECROSIS GLANDULAR MENOR DEL 30%
GRADO D: IGUAL A GRADO C MAS: COLECCION EXTRAPANCREATICA UNICA NECROSIS GLANDULAR DEL 30 AL 60 %
GRADO E: IGUAL A GRADO D MAS: COLECCION EXTRAPANCREATICA EXTENSA EN DOS O MAS ESPACIOS OCUPADOS NECROSIS GLANDULAR MAYOR AL 60 %
GRADO A Y B CORRESPONDEN A PANCREATITIS LEVE CON EVOLUCION FAVORABLE GRADO D Y E CORRESPONDEN A PANCREATITIS SEVERAS CON ALTO INDICE DE COMPLICACIONES
TRATAMIENTO
La piedra angular del tratamiento es el mantenimiento. El alivio del dolor, la recuperación de la volemia y la cuidadosa observación para prevenir las complicaciones; puede ser necesario la administración IV de calcio, insulina o la administración de oxigenoterapia La aspiración con SNG alivia el íleo. Los antibióticos no previenen las complicaciones sépticas, se administran cuando existe enfermedad biliar o si se demuestra un absceso pancreático. El glucagon, los anticolinérgicos, cimetidina, inhibidores enzimáticos se han mostrado ineficaces en estudios clínicos controlados. La intervención quirúrgica estaría indicada cuando hay diagnóstico dudoso, colangitis por obstrucción, o complicaciones como el seudoquiste o absceso.
COMPLICACIONES
Fracaso renal, colapso cardiovascular, insuficiencia respiratoria, hemorragia digestiva, la infección y diversos trastornos metabólicos, como desequilibrios electrolíticos e hipocalcemia.
Complicaciones locales poco frecuentes:
Fístulas pancreáticas, ascitis, obstrucción de la vena esplénica, colestasis por estenosis del colédoco en su porción intrapancreática. En 15 % de los pacientes se desarrolla una masa abdominal que puede corresponder a flemón, producto de la inflamación y edema pancreáticos y al seudoquiste, colección de líquidos y detritus necróticos, sin auténtica pared epitelial. El cuadro clínico incluye: dolor abdominal, masa palpable creciente, fiebre e hiperamilasemia mantenida. El diagnóstico se corrobora por TAC o ecografía. Las complicaciones posibles son: infección secundaria, rotura, hemorragia y la obstrucción de una estructura adyacente. A menudo es necesario realizar drenaje quirúrgico, marsupialización a intestino o estómago, a veces puede ser útil el drenaje transcutáneo con aguja, o el drenaje transcutáneo mediante un cateter «Pig Tail» que se deja por un tiempo más o menos prolongado.
PANCREATITIS CRONICA
Puede clasificarse en recidivante o no recidivante, como resultado de los cambios histológicos que se producen se manifiestan deficits en la función endócrina o exócrina o mixta que pueden ser más o menos evidentes desde el punto de vista clínico.
Etiología
En EE UU el 75 % de las pancreatitis crónicas se producen en alcoholistas crónicos de larga evolución. Pocas veces se debe a una enfermedad del tracto biliar. La pancreatitis hereditaria es una enfermedad poco frecuente, de caracter autosómico recesivo, que produce dolores abdominales, con comienzo en la infancia y puede llevar a una pancreatitis crónica calcificante. Otros factores etiológicos poco frecuentes son: la fibrosis quistica, deficit proteico grave, hiperparatiroidismo y la hiperlipemia.
Fisiopatología y anatomía patológica
En la pancreatitis crónica calcificante de origen alcoholico, el páncreas puede estar engrosado o atrófico, con conductos dilatados y ocupados por un líquido espeso, rico en proteinas. Histológicamente existe dilatación ductal irregular,con epitelio de revestimiento hiperplásico o metaplásico y fibrosis circundante. También pueden ser factores patogénicos importantes: el reflujo de líquido duodenal, la hipersecreción de calcio y los déficits nutricionales. El cuadro es progresivo independientemente de que se suspenda la ingesta de alcohol El cuadro de malabsorción es de aparición tardía.
DATOS CLINICOS
Dolor abdominal, habitualmente sordo, no cólico, en epigastrio con irradiación frecuente a espalda. pueden existir brotes recurrentes o molestias permanentes con exacerbaciones periódicas En 2/3 de estos pacientes se encuentra intolerancia a carbohidratos mientras que en la mitad de ellos se encuentra diabetes melitus de dificil control. Como complicaciones de la diabetes pueden surgir la retinopatía diabética, nefropatía y neuropatía. La esteatorrea y creatorrea se deben a la insuficiencia pancreática exócrina avanzada, puede no haber diarrea o ser ligera. Puede conservar el apetito, la aparición en las heces de gruesas gotas de aceite es sugestivo de enfermedad pancreática crónica. Pérdida de peso por esteatorrea e ingesta escasa por miedo al dolor. La exploración física solo revela malestar abdominal, o puede existir la masa de un seudoquiste. Durante los brotes de dolor puede existir hiperbilirrubinemia e ictericia.
DIAGNOSTICO
Hiperamilasemia, hiperglucemia, pruebas hepáticas pueden estar anormales. Calcificación pancreática en la Rx directa de abdomen. En la radiografía del tránsito intestinal desplazamiento de las asas duodenales, con irregularidades mucosas. Mediante colangiografía EV o trans-hepática se observa un afilamiento del colédoco en su porción distal, debido a fibrosis circundante. La ecografía y la TAC permiten la visualización de engrosamiento difuso o localizado, atrofia y calcificaciones, es dificil en ocasiones diferenciar el carcinoma de la pancreatitis crónica, sin embargo permiten un diagnóstico exacto en los seudoquistes y en las obstrucciones de la vía biliar. La TAC helicoidal y la Ultrasonografía Endoscópica permiten agudeza en el diagnóstico, sobre todo para la diferenciación de los cuadros malignos, por punción guiada. La Gammagrafía es de poca utilidad. Angiografía puede llegar a permitir el diagnóstico diferencial entre neoplasia y pancreatitis. La prueba diagnóstica más específica es la colangio-pancreatografía endoscópica retrógrada que permite visualizar el conducto pancreático en más del 90 % de los pacientes pudiendo observarse las alteraciones características de este proceso: conductos tortuosos, dilatados, calcificaciones y seudoquistes. La malabsorción de grasas se pone de manifiesto mediante la cuantificación de la grasa existente en las heces de 72 Hs. El paciente consume una dieta de contenido graso conocido, de 80 a 100 gs, durante un período previo de 2 días, siguiendo con la dieta durante los días de recolección; es sugerente de esteatorrea la excreción de grasas que supera el 6 al 9 % de lo ingerido. La tinción de las heces con Sudan es un método simple, rápido y barato para el estudio de la esteatorrea, Siempre existe grasa en las heces pero en los casos de malabsorción es muy superior. La absorción de D-Xilosa, como la biopsia de intestino delgado son normales. La presencia de fibras musculares en las suspensiones fecales, identificables por sus estriaciones, es sugerente de maldigestión. La medición de ácido paraaminobenzoico excretado en la orina (escindido específicamente por la quimotripsina pancreática de un péptido sintético previamente ingerido), constituye una prueba específica de malabsorción por enfermedad pancreática Las pruebas de función pancreática, miden el volumen de bicarbonato y el contenido enzimático del jugo pancreático secretado al duodeno, tras estimulación con secretagogos como secretina, colecistocinina o comidas de prueba. Pueden obtenerse valores anormalmente bajos aun en estadíos recientes de la pancreatitis crónica, pero dichos resultados se observan también en el cáncer de páncreas.
DIAGNOSTICO DIFERENCIAL
Diferenciar entre pancreatitis crónica y carcinoma. En muchos casos resultan suficientes los datos clínicos y las pruebas radiológicas convencionales, pero en ocasiones es necesario realizar una colangiopancreatografía retrógrada, angiografía e incluso laparotomía exploradora. La biopsia de intestino y las pruebas de función pancreática permiten descartar las causas de malabsorción de origen en la pared intestinal
TRATAMIENTO
Control del dolor abdominal. Si aparecen brotes agudos, se tratarán como a la pancreatitis aguda. Bloqueo del nervio esplácnico puede resultar temporalmente efectivo. El dolor disminuye conforme la enfermedad progresa y se va desarrollando la insuficiencia pancreática exócrina. Dieta: Suprimir la ingesta de alcohol, reducción de ingesta de lípidos de cadena larga, ingesta suplementaria de vitaminas liposolubles, especialmente vitamina D. El tratamiento de la esteatorrea en la insuficiencia pancreática avanzada, se realiza mediante extractos pancreáticos exógenos, con lipasa. La cirugía se puede hacer necesaria si existen complicaciones como seudoquistes, ascitis pancreática u obstrucción biliar. Cuando el conducto principal está dilatado, se suele hacer drenaje caudal (Operación de Du Val) o lateral del conducto hacia la luz de un asa yeyunal (Operaciones de Puestow o de Catell Mercadier). La resección de parte de la glándula o de toda ella está indicada en caso de pancreatitis difusa o localizada sin dilatación ductal. También puede estar indicada la cirugía sobre la vía biliar o sobre el esfinter de Oddi
CANCER DE PANCREAS EXOCRINO
Es el 2º de los cánceres del tracto digestivo en los EE UU. Es de pronóstico sombrío, con un promedio de super-vivencia después del diagnóstico de solo 5 meses. La incidencia del carcinoma de páncreas es mayor en el sexo masculino, en la raza negra, en paises desarrollados y conforme aumenta la edad. Se mencionan como probables agentes etiológicos a carcinógenos químicos como nitrosaminas, antraceno; el hábito de fumar, reflujo duodenal, pancreatitis crónica, diabetes mellitus, alcoholismo, ingesta de café, enfermedades de la vía biliar
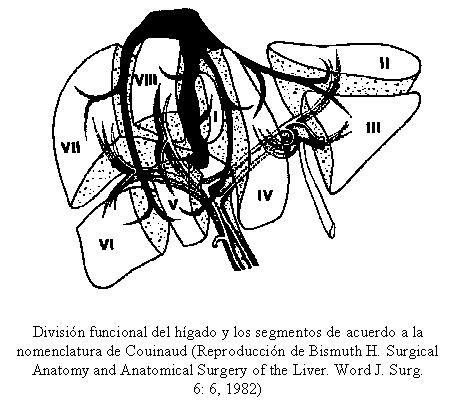
Anatomía patológica Los tumores benignos del páncreas son poco frecuentes y habitualmente quísticos. El 70 % de los carcinomas se originan en la cabeza de la glándula. Diferenciar de los carcinomas periampulares y de los cistoadenocarcinomas, de mejor pronóstico. Distalmente a la obstrucción producida por el carcinoma, puede producirse una pancreatitis crónica. La diseminación puede producirse por extensión directa, ganglionar y las mtts. viscerales son comunes en hígado, pulmones y huesos.
Hallazgos Clínicos
Relación 2 : 1 a predominio masculino, en los tumores pancreáticos exócrinos. Molestias inespecíficas, como depresión o ansiedad, constituyen los primeros síntomas en el 50 % de los pacientes. La tríada clásica de dolor abdominal, pérdida de peso e ictericia obstructiva, indica un cáncer de la cabeza de páncreas, ya avanzado. Una vesícula biliar aumentada de tamaño, indolora a la palpación, en un paciente ictérico sin cólico biliar, es indicativa de una obstrucción maligna del colédoco terminal (Signo de Curvoisier). Cuando se obstruye el sistema ductal pancreático, aparece esteatorrea El cáncer ubicado en el cuerpo o en la cola puede producir obstrucción de la vena esplénica, hipertensión portal y hemorragia gastrointestinal. El dolor abdominal es persistente, a menudo post-prandial nocturno, localizado en la porción superior del abdomen Pérdida de peso progresiva, repugnancia por los alimentos
Otros síntomas
Prurito, ascitis, hepatoesplenomegalia, estreñimiento. En el 25 % de los pacientes aparece diabetes. Hallazgos físicos: Ictericia, dolor, masa abdominal palpable o vesícula biliar palpable. Manifestaciones poco frecuentes: tromboflebitis migratoria, nódulos grasos subcutáneos palpables, poliartralgias y soplos, por compresión de vasos viscerales; pueden asociarse a hipoglucemias, hipercalcemia, síndromes de Cushing y Carcinoides
DIAGNOSTICO
En la mayoría de los pacientes es imposible el diagnóstico precoz, los síntomas aparecen cuando la neoplasia se ha extendido, no existen pruebas de exploración selectiva para aplicar a personas asintomáticas. La duodenografía hipotónica tiene un 50 % de positividad en personas sintomáticas. Tiene escaso valor discriminativo y solo se ve cuando la tumoración es grande. Las pruebas diagnósticas más efectivas son: La ecografía, la TAC, RMN la Colangiopancreatografía endoscópica retrógrada y la arteriografía. En el 90 % de las ERCP, en los pacientes con carcinoma de páncreas, se observa una obstrucción abrupta e irregular del conducto pancreático, o una obstrucción del colédoco por compresión extrínseca. Los tumores pancreáticos están poco vascularizados, el signo angiográfico principal es la desviación o el secuestro vascular. El estudio citológico del líquido pancreático o duodenal es útil solo cuando resulta positivo, se obtienen 50 % de falsos negativos. La gammagrafía hepática, la TAC, o la ecografía, pueden poner de manifiesto mtts. hepáticas. La citología por punción transcutánea de una masa pancreática (dirigida por ecografía, Ultrasonografía Endoscópica, o TAC) es una prueba precisa, para pacientes en los que no se logra establecer el diagnóstico por métodos menos agresivos,pero actualmente está en discusión debido al riesgo de que se produzca siembra neoplásica en el trayecto de punción. Bansal y Kadish demuestran que el ultrasonido endoscópico (U.E.) constituye el método ideal para definir la profundidad de la penetración del tumor, el compromiso de ganglios regionales y el compromiso vascular. En última instancia puede ser necesaria la laparotomía exploradora tanto para el diagnóstico como para el tratamiento
DIAGNOSTICO DIFERENCIAL
Pancreatitis crónica, vasculopatía mesentérica (angor abdominal, puede aparecer dolor abdominal y pérdida de peso), linfoma retroperitoneal, hepatopatías colestásicas, coledocolitiasis, carcinomas ampulares, carcinomas de vías biliares.
TRATAMIENTO Y PRONOSTICO
Enfermedad fatal, supervivencia del 2 % a los 5 años, en la mayoría de los casos el tratamiento es paliativo; las técnicas de derivación biliodigestiva: Colédoco o hepático-yeyuno anastomosis asociadas a gastroyeyunostomía, alivian transitoriamente la obstrucción biliar y gástrica. El bloqueo del nervio esplácnico puede reducir el dolor. La cirugía curativa rara vez es aplicable en los tumores de cuerpo y cola, ya que en el momento del diagnóstico, suele haber casi siempre mtts. locales o a distancia. La resección cura el cáncer localizado a la cabeza solo en un 15 % de los casos. La céfalo-duodeno-pancreatectomía (operación de Whipple) presenta una mortalidad operatoria que varía desde un porcentaje inferior al 5% (Pitt H. 1995), a mortalidad cercana al 20% en centros de menor especialización; tiene una elevada morbilidad y da una supervivencia inferior a los 5 años en el 95% de los pacientes. Algunos prefieren la pancreatectomía total, por menor riesgo de recidiva o persistencia por multicentricidad, o para evitar dehiscencia de anastomosis. En tumores irresecables: Quimioterapia y radioterapia pueden estar indicados, con resultados aún pobres. La colocación de dispositivos tubulares o cestillas metálicas expansibles, por vía percutánea transhepática o por vía endoscópica retrógrada, que impiden una rápida obstrucción del conducto biliar (Stents), puede ofrecer una paliación aceptable, especialmente para la ictericia y el prurito.
NEOPLASIAS ENDOCRINAS MULTIPLES
Los tumores funcionantes del páncreas tienen una asociación porcentual con uno de los tipos de Neoplasias Endócrinas Múltiples, aunque también existen formas esporádicas, sin compromisos de otras glándulas Clásicamente, un médico debe reconocer la presencia de un MEN ante dos circunstancias: a) asociación de lesiones hiperplásicas o tumorales de varias glándulas endocrinas (tiroides, paratiroides, hipófisis, adrenales, páncreas endocrino), y b) familiares de pacientes con la mencionada enfermedad, que mediante diferentes métodos bioquímicos o genéticos de detección sistemática muestran ser portadores de una lesión glandular tumoral o hiperplásica, cuando éstas aún no se han desarrollado clínicamente. Los tipos celulares de estos tumores parecen tener un precursor embriológico en el neuroectodermo y una vía común de tipo bioquímico (amin precursor uptake decarboxilation), por lo que se agrupan genéricamente en el sistema APUD. Se cree que la transformación neoplásica de las células APUD) puede deberse a la pérdida heredable de un gen supresor tumoral y/o a la mutación de un protooncogén antes de que las células del neuroectodermo emigren hacia sus respectivos tejidos; es lo que hoy en día se conoce como teoría APUD.
ALTERACIONES GENETICAS. El defecto genético responsable del MEN-I, que es el tipo de NEOPLASIAS ENDOCRINAS MULTIPLES en las que se encuentra el compromiso del páncreas endócrino,se localiza en el brazo largo del cromosoma 11 (llq13). Su carácter es de herencia dominante con alta penetración. FORMAS CLINICAS. Neoplasia endocrina múltiple tipo 1. En 1954 se describió por primera vez la asociación de hiperplasia paratiroidea, tumores hipofisarios multicéntricos y tumores pancreáticos en varias familias. Participan, por lo tanto, en este síndrome tres glándulas, sin aparente conexión entre ellas: las Paratiroides, la hipófisis y el páncreas. Esta es la forma más frecuente de MEN. La expresión del síndrome aumenta con la edad. Aunque la afectación de las tres glándulas señaladas constituye la presentación más usual, también se han publicado hiperplasia corticosuprarrenal y alteraciones nodulares del tiroides. El hiperparatiroidismo asociado al MEN-I se produce generalmente por una hiperplasia de las cuatro glándulas, mientras que el hiperparatiroidismo primario esporádico se origina por la transformación adenomatosa de una sola de estas glándulas. El hiperparatiroidismo suele ser la manifestación más común y temprana del MEN-1 (80-95 % de los casos). Las manifestaciones clínicas son similares a las descritas en el hiperparatiroidismo primario esporádico: nefrolitiasis, osteoporosis, debilidad muscular, cambios en la esfera intelectual y emocional, etc. La transformación neoplásica de las células de los islotes pancreáticos es el segundo componente más observado en el síndrome, ocurriendo en aproximadamente el 80 % de los casos. Estos tumores suelen ser multicéntricos y a menudo son capaces de sintetizar diversos péptidos y aminas biógenas. Se identifican en función de la sustancia hormonal que predominantemente secretan y muestran una característica progresión desde la forma histológica de hiperplasia hasta la neoplasia con metástasis. Los tumores pancreáticos pueden originarse de células de los islotes (eutópicas) o bien de células que no son constituyentes habituales del páncreas adulto (ectópicas).
El gastrinoma, la neoplasia pancreática más frecuente en el MÉN-1 (57-78 % de los casos), es un tumor ectópico, puesto que las células G de las cuales deriva sólo están normalmente situadas en el páncreas fetal. Cabe destacar que los gastrinomas pueden producirse independientemente del MEN-1. (sólo el 15-48 % de todos los pacientes diagnosticados de gastrinoma presentan un MEN-1). La excesiva producción de gastrina que realizan estos tumores incrementa la secreción ácida gástrica, lo cual origina úlceras duodenoyeyunales y diarrea. Por lo general, la secreción basal de ácido clorhídrico supera los 15 mmol/ hora y las concentraciones en ayunas de gastrina suelen ser superiores a 300 pg/ml. Otros tumores pancreáticos que se asocian con menor frecuencia al MEN-1 son glucagonomas, somatostatinomas y tumores secretores de polipéptido intestinal vasoactivo (Vipomas). La medición periódica de las distintas hormonas implicadas en el Síndrome constituye la mejor alternativa para detectar la enfermedad entre los familiares. Las manifestaciones clínicas del MEN-1 raramente aparecen antes de los 15 años. La práctica totalidad de los individuos en riesgo desarrollan la enfermedad hacia los 40 años de edad. El hiperparatiroidismo suele ser la primera manifestación del síndrome; por lo tanto, la medición de los valores de calcio y de paratohormona constituye el mejor método de detección en los portadores asintomáticos. De lo antes expuesto se deduce que los tumores del páncreas endocrino, si bien son relativamente raros, con respecto a los del páncreas exócrino, se desarrollan de células de origén embriológico común, pueden ser tumores no funcionates, o producir síndromes clínicos por hormonas gastrointestinales. Aparecen aislados o formando parte de la adenomatosis endócrina múltiple, pudiendo secretar una o varias hormonas
Insulinomas
Son raros, a menudo susceptibles de curación quirúrgica. Se caracterizan por episodios recurrentes de hipoglucemia en ayunas. En el 80 % de los casos se demuestra un pequeño tumor benigno aislado en el interior del páncreas, mientras que en el 10 % de los casos existen metástasis cuando se realiza el diagnóstico. En los demás casos los tumores son multicéntricos, habiendo en este subgrupo una elevada incidencia de adenomatosis endócrina múltiple.
Síntomas
Cefalea, alteraciones visuales, confusión, astenia, sudoración y palpitaciones. Las convulsiones y el coma, son infrecuentes y solo aparecen en relación a hipoglucemias graves y mantenidas. Los síntomas aparecen varias horas tras la ingesta y muchas veces se confunden con alteraciones neurológicas o siquiátricas durante los accesos pueden observarse deficits neurológicos transitorios.
Diagnóstico
Requiere demostración repetida de hipoglucemia (< 40 mg/dl), junto con la aparición espontanea o provocada de los síntomas, hiperinsulinemia anormal y alivio de los síntomas tras la inyección de carbohidratos. Cuando el cuadro clínico se presenta con escasa frecuencia, se deja al paciente en ayuno prolongado para comprobar la hipoglucemia. La angiografía es extremadamente precisa para localizar el tumor.
Tratamiento
Extirpación quirúrgica. Cuando existen mtts. no resecables, el diazóxido se usa para prevenir los síntomas de hipoglucemia y la estreptozocina puede lograr la regresión parcial del tumor.