Ascitis. Mecanismos de producción. Diagnóstico y Tratamiento
Las afecciones crónicas del hígado son las causas más comunes de la ascitis e implican la presencia de hipertensión portal.
DIAGNOSTICO
La principal manifestación de la ascitis es la distensión abdominal, la mayoría de las veces de aparición insidiosa: el paciente nota un cambio del tamaño de su cintura y la necesidad de modificar o cambiar la ropa.
El dolor no es un signo característico, aunque algunas veces existe una molestia dorsal imprecisa. La disnea aparece cuando la ascitis está a tensión. Muchas veces el examen físico muestra un paciente ictérico con evidencias de deterioro muscular.
El abdomen está distendido y se observan venas abdominales prominentes con circulación colateral de tipo portal, que se irradian desde el ombligo en dirrección cefálica y/o caudal. La matidez desplazable de los flancos es el signo más temprano de
ascitis. El hígado y el bazo son de difícil palpación cuando existe ascitis abundante, pero pueden provocar el signo del témpano.
Se puede encontrar onda ascítica.
El aumento de la tensión abdominal, puede producir la protrusión de las hernias, la mayoría de las cuales son umbilicales aunque también se observan las inguinales y a través de anteriores laparotomías.
Las radiografías simples de abdomen pueden mostrar hepatoesplenomegalia, opacidad difusa del abdomen con eliminación de la sombra de los psoas y separación de las asas intestinales. La radiografía de tórax puede revelar derrames pleurales.
La ecografía es de utilidad para el estudio de la ascitis, ya que puede detectar la presencia de cantidades pequeñas de líquido, aún 100 ml.
La presencia de ascitis se confirma con la paracentesis diagnóstica
En la cirrosis el líquido es un trasudado con una densidad inferior a 1.016 y una concentración de proteínas inferior a 2,5 gm/100 ml. El recuento celular es inferior a 300/ mm3, en su mayor parte constituido por células mononucleares.
DIAGNOSTICO DIFERENCIAL
La ascitis aparece en otros dos tipos de hipertensión portal: la obstrucción de las venas suprahepáticas (síndrome de Budd Chiari) y la trombosis de la vena porta.
En la obstrucción de las venas suprahepáticas el comienzo de la ascitis suele ser brusco. La ictericia es leve o está ausente y el hígado está muy agrandado, doloroso, de consistencia aumentada y de superficie lisa.
La ascitis es rara en presencia de trombosis portal no complicada pero puede aparecer luego de tratamientos infructuosos para su corrección quirúrgica.
La ascitis se desarrolla en algunos casos como complicación de las anastomosis portosistémicas. Por lo general, en estos casos se debe a insuficiencia hepatocelular o a la excesiva administración posoperatoria de soluciones salinas.
La ascitis muestra una particular predilección para aparecer en presencia de flujo portal invertido.
Por último, la ascitis en el posoperatorio puede deberse en algunos casos, a la trombosis de la anastomosis venosa.
Fuera de la hipertensión portal existen otras causas de ascitis
1. Ascitis relacionadas con neoplasias peritoneales. El líquido ascítico puede ser muy hemorrágico o contener hematíes; la concentración de proteínas es mayor que 2,5 gm/ l00 ml.
2. Ascitis relacionada con la tuberculosis. El líquido es turbio. Hay aumento del número de células, en especial de linfocitos. El diagnóstico se establece por el cultivo de los bacilos ácidorresistentes o por el estudio histológico de los granulomas.
3. Ascitis pancreática. Suele encontrarse asociada con seudoquistes de páncreas. El líquido tiene elevada concentración de proteínas y amilasas.
4. Ascitis quilosa debida al bloqueo linfático, en general por un linfoma.
Puede constituir también una complicación de un trauma quirúrgico inferido a la cisterna quilosa.
El líquido ascítico es de aspecto lechoso por su elevado contenido en lípidos, que puede demostrarse por la coloración con Sudán III.
5. Ascitis relacionada con la nefrosis, se acompaña con edemas generalizados y albuminuria.
6. Ascitis relacionada con la pericaditis constrictiva. El diagnóstico se reafirma por la presencia de calcificaciones pericárdicas, ingurgitación yugular y pulso paradojal.
PATOGENIA
Los factores que facilitan el desarrollo de la ascitis en la cirrosis son una combinación de hipertensión portal, reducción de la presión coloidosmótica intravascular por la hipoalbuminemia y aumento de la filtración de linfa a nivel de los linfáticos hepáticos distendidos.
El cambio principal que se observa en el sistema neurohormonal, es el aumento de la actividad simpática y el hiperaldosteronismo. El aumento de la actividad simpática debido a la estimulación de los barorreceptores, como consecuencia de la reducción del volumen intravascular.
Aumento de la retención de sodio. El aumento de la aldosterona se debe a la estimulación de la corteza adrenal por angiotensina.
En el paciente con cirrosis, se liberan grandes cantidades de renina como respuesta del aparato yuxtaglomerular a la redistribución del flujo sanguíneo y a la reducción de la irrigación de la corteza renal.
Existe además una alteración del clearence de agua, secundaria al aumento de la hormona antidiurética.
COMPLICACIONES DE LA ASCITIS
Los pacientes con cirrosis y ascitis están expuestos a desarrollar dos complicaciones importantes: la peritonitis bacteriana y el síndrome hepatorrenal.
La peritonitis bacteriana y la bacteriemia aparecen en forma espontánea sin
una aparente fuente clara de infección. Los síntomas principales son fiebre, dolor abdominal y disminución de los ruidos intestinales. El examen del líquido ascítico revela una elevada densidad, gran concentración de proteinas, y un recuento elevado de células. Leucocitos (> 300/ml). El hallazgo de más de 500 polimorfonucleares por ml es evidencia de peritonitis bacteriana aun en pacientes asintomáticos. Las bacterias que con mayor frecuencia se cultivan son la Escherichia colí,neumococos y estreptococos beta-hemolíticos. Las bacterias anaerobias sólo rara vez producen peritonitis.
El síndrome hepatorrenal se caracteriza por su aparición lenta, con oliguria y azoemia asociada con el deterioro de la función hepática. La diuresis diaria puede disminuir hasta llegar a sólo l00 o 150 ml, pero nunca llega a la anuria total. Son factores precipitantes reconocidos la depleción aguda del volumen plasmático secundaria a la administración de diuréticos, la paracentesis, las hemorragias digestivas o la septicemia. La causa de la insuficiencia renal parece estar vinculada con la redistribución del flujo renal excluyendo a los glomérulos.
El síndrome hepatorrenal debe ser diferenciado del daño tubular agudo, que puede ser producido por hipotensión, hipokalemia o exceso de administración de neomicina. En el daño tubular agudo el sedimento urinario muestra cilindros celulares
y anormalidades en la capacidad de concentración y retención de sodio.
No existe tratamiento específico para el síndrome hepatorrenal. Se trata, como otras situaciones de insuficiencia renal, mediante la restricción de los líquidos, sodio, potasio y proteínas. En algunos casos, la infusión de dopamina o la colocación de las derivaciones peritoneovenosas han producido mejorías de la función renal.
TRATAMIENTO MEDICO
Como consecuencia de la incapacidad que muestra el paciente cirrótico para excretar el sodio en forma efectiva, la mayor parte del sodio contenido en la dieta es retenido.
El tratamiento principal de la ascitis se basa en la restricción del sodio.
La natremia baja indica la retención de líquidos por encima del sodio retenido.
Los pacientes cirróticos tratados con reposo en cama y restricción de agua y sodio suelen desarrollar una diuresis espontánea que coincide con la mejoría de su función hepática.
El uso de diuréticos, con control de los electrolitos séricos, urea y creatinina se inicia con Espironolactona, que actua inhibiendo la acción de aldosterona, produciendo un aumento de la excreción de sodio y también reduce la pérdida de potasio. La dosis inicial es de 100 mg / día, que puede ser incrementada en forma gradual hasta 400 mg/día. La ginecomastia puede complicar la administración prolongada de espironolactona.
Para obtener una diuresis más efectiva se combina con hidroclorotiazida, 50 a 100 mg/día, o fursemida en dosis de 40 mg /día, pero puede producir una pérdida exagerada de potasio, por lo que se lo administra a este elemento en tabletas.
Las paracentesis diaria de 4 a 6 litros, junto con la infusión intravenosa de 40 g de albúmina pobre en sodio, ha sido efectiva para su control.
PRONOSTICO Y RESULTADOS DEL TRATAMIENTO MEDICO
El pronóstico de los pacientes con afecciones hepáticas que presentan ascitis es malo; se estima una supervivencia media de 2 años cercana al 40%. Este pronóstico depende, en forma especial, del estado funcional del hígado.
Es obvio que cuanto más avanzada es la afección hepática, con ictericia y encefalopatía, peor es el pronóstico.
La respuesta satisfactoria a los diuréticos, que determina el control de la ascitis pero no en forma necesaria su eliminación, se observa en el 75 % de los pacientes.
TRATAMIENTO QUIRURGICO
Cerca del 5% de los pacientes no muestran ninguna mejoría con el tratamiento médico y otro 20% sólo presentan una respuesta parcial. Para este grupo de pacientes se han ideado diversos tratamientos quirúrgicos. Ninguno de ellos tiene en la actualidad aplicación alguna en el tratamiento de la ascitis.
La única operación que en la actualidad se utiliza para el tratamiento de la ascitis refractaria al tratamiento, es la derivación peritoneo-venosa. Las derivaciones porto-sistémicas, no indicadas sólo para el tratamiento de la ascitis, han determinado
consecuencias sobre la ascitis que merecen especial consideración.
La ascitis es muchas veces un signo de enfermedad hepática avanzada y en algunos casos el trasplante hepático está indicado para revertir la insuficiencia hepática y aliviar la ascitis.
Efecto de las derivaciones portosistémicas
La presión sinusoidal aumentada, secundaria al bloqueo post sinuosidal, es uno de los factores involucrados en la producción de la ascitis.
Esta hipertensión sinusoidal causa, en forma presumible, aumento de la linfa hepática en los espacios de Disse y la formación de ascitis. El hiperaldosteronismo secundario está también relacionado de alguna forma con ese fenómeno. La mayoría de las derivaciones portosistémicas reducen la presión sinusoidal y, por ello, tienden a aliviar la ascitis, aunque algunas son más efectivas que otras en relación con ese
efecto.
La anastomosis portocava término-lateral elimina el aporte portal al flujo hepático y de esta forma reduce la presión intrahepática. Sin embargo, esos shunts no reducen la hipertensión sinusoidal a niveles normales. Por otra parte, tampoco mejoran la salida de la sangre hepática. Por ello, en los pacientes con estancamiento bidireccional, o con flujo portal invertido espontáneamente, esas anastomosis pueden condicionar aumento de la presión sinusoidal al eliminar la posibilidad del flujo retrógrado a través de la vena porta. Por esta razón es probable que entre el l0 y el 15% de los pacientes desarrollen ascitis luego de la creación de un shunt portocava término-lateral.
La anastomosis portocava látero-lateral no sólo deriva del hígado la sangre esplácnica sino que también sirve como tracto de salida para el flujo retrógrado de la sangre portal desde el hígado hacia la vena cava de menor presión. Es probable que, por esta razón, la presión sinusoidal se reduzca hasta lo normal luego de esas derivaciones. Por lo tanto, la anastomosis portocava látero-lateral ha mostrado ser efectiva para el tratamiento de la ascitis refractaria al tratamiento, controlando tanto el hiperaldosteronismo como el exceso de producción de linfa hepática.
Existen diversas técnicas para las derivaciones portosistémicas que en realidad funcionan como shunts látero-laterales. Entre ellas se incluyen el shunt esplenorrenal común, el mesocava directo, el mesocava con injerto en H, el portorrenal y otros, cuyos efectos fisiológicos son similares a los producidos por las anastomosis látero-laterales y hacen pensar que pueden ofrecer la misma efectividad.
Debe hacerse notar que los shunts portosistémicos electivos, como el esplenorrenal, han sido diseñados para preservar el flujo mesentérico-portal y por lo tanto, mantener una presión sinusoidal elevada y por ello tienden a producir o agravar la ascitis.
Estas operaciones no deben ser utilizadas sólo para el tratamiento de la ascitis. Sin embargo, cuando se precisa un shunt para controlar las várices esofágicas sangrantes, la selección específica del tipo de derivación que debe practicarse, por lo menos en parte, debe considerar la presencia o ausencia de ascitis grave o intratable.
PARACENTESIS
Esta terapéutica sigue siendo practicada; ya no se considera apropiado drenar la ascitis en forma completa, En la actualidad, el paciente se coloca en posición supina. Es importante que la vejiga esté vacía. Los lugares de preferencia para la inserción del catéter o el trócar se encuentran en la línea media, a un tercio de la distancia umbilicopubiana o inmediatamente por fuera del músculo recto anterior y en cualquiera de los cuadrantes inferiores. Se desinfecta y aisla la zona seleccionada y luego se efectúa anestesia local con lidocaina. Para la paracentesis se pueden utilizar diferentes técnicas pero quizás la más simple sea la de agregar tres orificios laterales en la porción terminal de un catéter común. Luego de punzar la cavidad abdominal con un trócar se introduce el catéter, se extrae el trócar y luego se aspira con una jeringa de tres vías. El catéter puede ser fijado a una tubuladura para infusiones intravenosas que se conecta a un recipiente colector colocado en el suelo, dejando que el líquido ascítico fluya por efecto de la gravedad.
DERIVACION PERITONEOVENOSA
La válvula activada por presión, diseñada por Leveen, se abre sólo cuando existe un gradiente de 3 a 5 cm de H2O entre la presión peritoneal y la de la vena cava superior intratorácica. De esta forma, si la presión venosa sube por la infusión excesiva de líquido ascítico, la válvula se cierra y evita el retroceso de la sangre hacia el tubo y su trombosis.
Los drenajes peritoneovenosos pueden insertarse bajo anestesia local, aunque se prefiere la general, cuando es posible, debido a la dificultad existente para la creación del túnel subcutáneo bajo los efectos de la primera.
En el preoperatorio se debe obtener una muestra de líquido ascítico para su cultivo y recuento celular. La colocación de la derivación peritoneo-cava está contra-indicada si el cultivo es positivo o si el recuento revela más de 300 elementos por ml.
Se efectúa una incisión abdominal transversal de 4 a 5 cm por fuera del músculo recto anterior y por debajo del reborde hepático; se divulsionan los músculos abdominales hasta alcanzar el peritoneo. Se colocan sobre el peritoneo jaretas opuestas de tracción, de material absorbible 3-0, para luego efectuar la apertura peritoneal entre ellas. Se
considera como un hecho bien establecido que el riesgo de la coagulación intravascular diseminada posoperatoria puede reducirse en forma significativa si se elimina la mayor parte del líquido ascítico en el momento de la operación.
Una vez que se ha evacuado el volumen deseado, se extrae la cánula de aspiración y se introduce en el peritoneo el tubo perforado y el tallo de la válvula.
Se tracciona de ambas jaretas ajustando los hilos alrededor del tallo de la válvula y dejando que el tubo perforado se llene con líquido ascítico, luego de haber eliminado su contenido aéreo, para luego pinzarlo con una pinza de Kelly con ramas acolchadas con tubos de goma. El extremo venoso del tubo se arrolla y se fija con una hebra larga de seda para facilitar su tracción y pasaje a través del túnel subcutáneo. En la zona supraclavicular homolateral se traza una incisión vertical o transversal, por detrás del borde posterior del estemocleidomastoideo.
Se lleva este músculo hacia adentro y se reconoce la vena yugular interna para luego liberarla en una extensión de 3 o 4 cm y aislarla entre pinzas vasculares o asas de hilo. Se crea un túnel subcutáneo mediante un instrumento adecuado y luego se arrastra a su través el extremo venoso del tubo hasta alcanzar el cuello. Se mide el tubo con cuidado, de modo que pueda ingresar a la vena yugular y alcanzar sólo hasta el segundo espacio intercostal. Para evitar la trombosis temprana del sistema, es imperativo que el tubo venoso sea colocado en este nivel, es decir a la altura de la unión de la vena cava superior con la aurícula derecha. Se recorta el exceso del tubo en pico de flauta descartando el sobrante. La válvula misma queda por fuera del peritoneo y recubierta por los músculos, aponeurosis, tejido subcutáneo y piel, que se cierran todos con sutura continua, incluyendo la piel, a fin de evitar la filtración del líquido ascítico.
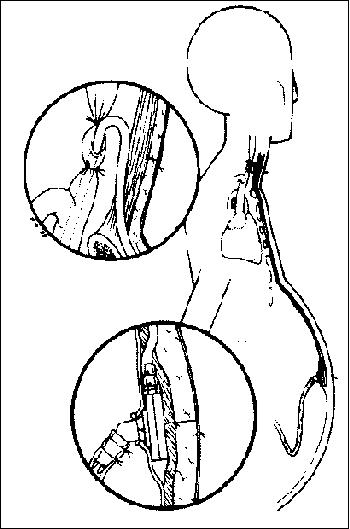 Diagrama que muestra la colocación de la derivación peritoneovenosa. La válvula se encuentra sobre el peritoneo y por debajo de los músculos abdominales. El tubo que se va a introducir en la vena se tuneliza en forma subcutánea a lo largo de la pared torácica hasta el cuello, donde ingresa en la vena yugular, (Tomado de Leveen H. H., Wapnick S., Grosberg S. and Kinney M. J.: Further experience with peritoneo-venous shunt for ascites. Ann. Surg., 184:574. 1976.)
Diagrama que muestra la colocación de la derivación peritoneovenosa. La válvula se encuentra sobre el peritoneo y por debajo de los músculos abdominales. El tubo que se va a introducir en la vena se tuneliza en forma subcutánea a lo largo de la pared torácica hasta el cuello, donde ingresa en la vena yugular, (Tomado de Leveen H. H., Wapnick S., Grosberg S. and Kinney M. J.: Further experience with peritoneo-venous shunt for ascites. Ann. Surg., 184:574. 1976.)
Muy buen contenido! Gracias por esta pagina